Un buon punto di partenza per quando si deve trovare la configurazione elettronica di uno ion è la configurazione elettronica dell’atomo neutro.
Nel tuo caso, devi trovare la configurazione elettronica dell’anione fluoruro, #”F”^(-)#, quindi inizia scrivendo la configurazione elettronica di un atomo di fluoro neutro, #”F”#.
Il fluoro si trova nel periodo 2, gruppo 17 della tavola periodica e ha un numero atomico di #9#. Questo ti dice che l’atomo di fluoro neutro ha un totale di #9# elettroni che circondano il suo nucleo.
La sua configurazione elettronica sarà
#”F:” 1s^2 2s^2 2p^5#
Ora, l’anione #”F”^(-)# si forma quando #1# elettrone viene aggiunto a un atomo di fluoro neutro.
Si noti che la subshell 2p dell’atomo neutro contiene # 5 # elettroni. La sua capacità massima è in realtà # 6 # elettroni, due elettroni per ogni p-orbitale.
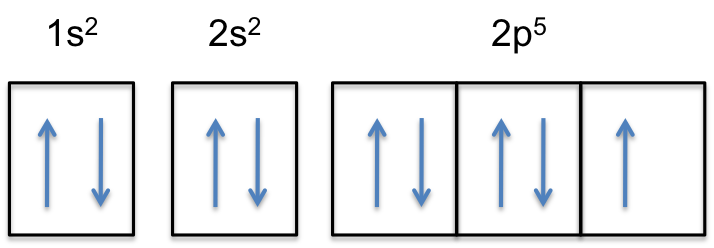
Ciò significa che il #color(red)(“extra electron”)# verrà aggiunto a uno dei tre orbitali 2p, diciamo a #2p_y#.
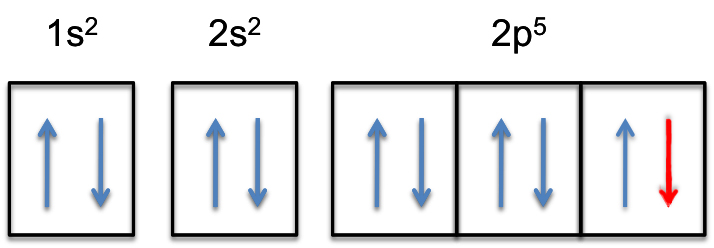
La subshell 2p sarà ora completamente riempita, cioè manterrà #6# elettroni.
La configurazione elettronica dell’anione fluoruro sarà quindi
#colore(verde) (/bar(ul(colore(bianco)(a / a)colore(nero) (“F”^( -):colore(bianco)(a) 1s^2colore(bianco)(a) 2s^2 colore(bianco)(a)2p^6)colore(bianco)(a/a)|)))#
Si noti che l’anione fluoruro ha un totale di #8# elettroni nel suo secondo guscio, il guscio più esterno. Questo ti dice che l’anione ha un ottetto completo.
Poiché l’anione fluoruro è isoelettronico con neon, #”Ne”#, puoi scrivere la sua configurazione elettronica usando la notazione stenografica del gas nobile come
#”F”^(-): #
Qui
# # – la configurazione elettronica di neon