Bene, considera la delocalizzazione della densità elettronica. Cioè quando la densità elettronica si diffonde il più possibile in tutta una molecola, in modo che l’accumulo di carica minima sia presente in un dato orbitale.
Che è descritto:
- collettivamente da tutti i contributori di risonanza nelle strutture di Lewis.
- collettivamente da tutti i singoli contributi orbitali molecolari nei diagrammi orbitali molecolari.
(Ci sono sottili differenze tra questi, ma questi sono approssimativamente analoghi per semplicità. Vedi qui per maggiori dettagli.)
La localizzazione della densità elettronica è la mancanza di ciò.
È quando riempiamo tutta la densità elettronica in alcuni orbitali, invece di diffonderla, e non succede quasi mai in una vera molecola o sistema quantistico (anche se non c’è risonanza in corso).
ESEMPIO CON STRUTTURE DI RISONANZA
Considerare il catione allilico isolato (non reagente), #”C”_3″H”_5^(+)#.
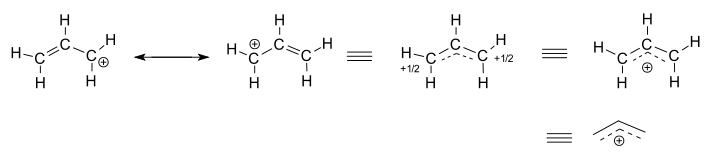
- Le due strutture di sinistra sono contributori di risonanza, ognuna delle quali sono rappresentazioni localizzate della vera struttura delocalizzata.
- Le tre strutture di destra sono ciascuna rappresentazioni della struttura ibrida di risonanza, o della struttura delocalizzata.
La struttura delocalizzata è fondamentalmente descritta da una raccolta di orbitali molecolari di legame.
ESEMPIO CON UN DIAGRAMMA ORBITALE MOLECOLARE
Si consideri nuovamente il catione allilico in un diagramma MO che descrive SOLO gli elettroni #bbpi# (cioè gli elettroni che sarebbero in un legame #pi# in un doppio legame localizzato!), ma permette la partecipazione alle reazioni:
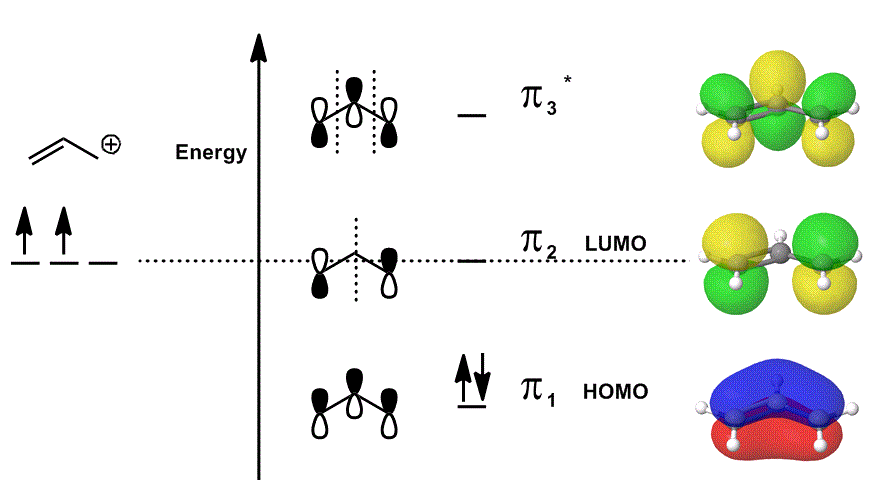
- Ciascuno dei contributi orbitali nel mezzo sono raffigurati localizzati; gli orbitali atomici che si sovrapporrebbero sono mostrati come se stessi (fase inclusa).
- Ciascuno degli orbitali all’estrema destra (uno per riga) sono raffigurati delocalizzati; la densità elettronica può diffondersi in modo che gli orbitali molecolari siano raffigurati con una considerazione completa di sovrapposizioni, nodi e fasi.
Quando si sovrappongono #pi_1#, # pi_2# e # pi_3^ ” * ” # e si incorpora il contributo ponderato di questi stati (ponderato secondo i coefficienti # c_i#), si ottiene la combinazione lineare di orbitali molecolari:
#Psi_(“allil”^(+)) = c_1overbrace(pi_1)^”bonding” + c_2overbrace(pi_2)^”nonbonding” + c_3overbrace(pi_3^”*”)^”antibonding”#
e #Psi_(“allil”^(+))# poi descrive la distribuzione complessiva degli stati che insieme descrivono la reattività del catione allilico.
In altre parole, #pi_1# (che dona #pi# elettroni di legame), #pi_2# (che accetta elettroni di legame), e #pi_3^”*”# (in questo caso, è raramente necessario partecipare) tutti fare qualcosa quando il catione allilico interviene in una reazione chimica, perché (se occupato), sono allo stesso tempo.