By Catherine Gara
January2016—粘液は私たちが考えたいものではないかもしれませんが、私たちの生活はそれに依存し 嚢胞性線維症(CF)では、粘液の肥厚は、他の症状の中でも、肺感染症および腸ブロックにつながります。 疾患は、疾患を引き起こすことが知られている1,700以上の突然変異のうちの1つまたは複数の影響を受ける単一の遺伝子によって引き起こされる。 Johns Hopkinsでは、研究者と臨床医の遺伝学者が協力して、遺伝子、そのタンパク質、患者の問題についてできることすべてを学び、収集した情報の各部分がCFを持つすべての個人の治療オプションを持つことに近づいていることを知っています。
Pass Me The Salt
最近、CF患者は頻繁な肺感染症を管理する治療のおかげではるかに優れていますが、CFの診断はまだ膵臓、肝臓、腸にかかる通行料のために38 問題は、cftrタンパク質の青写真を運ぶ嚢胞性線維症膜貫通コンダクタンスレギュレータ(CFTR)遺伝子の欠陥から来ています。 CFTRタンパク質は、フロントドアのメールスロットのようなものです。 それは細胞の内側と外側の間に小さな通路を形成する。
適切に動作すると、CFTRは塩化物イオン(塩の成分)のセル内および外への通過を制御するのに役立ちます。 肺や膵臓の管では、塩化物が細胞を離れると、水が続くように促します。 その水は粘液の薄い層を形成するのに役立ちます。 肺では、粘液はそこにあってはならないほこりや細菌を捕捉します。 肺を覆う細胞上の繊毛、または毛様構造は、粘液を気道まで口に運び、そこで飲み込まれて消化されます。 膵臓では、液体は食物消化を助けるために腸に酵素を運ぶのに役立ちます。 粘液が肺で粘性が高すぎると、繊毛はそれを動かすことができないので、細菌は感染症を引き起こすためにそこに残っています。
A Protein’s Path
遺伝医学研究所の教授であるGarry Cuttingと、生理学部門のディレクターであるBill Gugginoは、CFTR遺伝子とそのコードされたタンパク質をほとんどのキャリアで研究してきました。 カッティングの関心は、ジョンズ-ホプキンスに居住している間にCFと兄弟のペアを世話することに由来しています。 Gugginoの関心はさらに遠くに戻ります—彼の少年時代の海への旅行に。 彼は魚が塩水で生き残ることができる方法を疑問に思った、と彼は短い答えがあることを学びました:CFTRの彼らのバージョン。
単一の遺伝子とそのタンパク質産物に全体のキャリアを集中させることを想像するのが難しいと思われる場合は、代わりに1,480個の磁気ブロ CFTR遺伝子の変異は、多くの場合、最終的な三次元形態に劇的に影響を与えることができるアミノ酸の一つの変化を意味します。いくつかの変異は、タンパク質を作らない原因となります。
他のものは、部分的なタンパク質を合成することを可能にする。 これらの突然変異が起こるタンパク質の始まりに近いほど、その機能は悪化する。 他の突然変異はちょうど間違った場所で起こり、例えば塩チャネルが開くのを防ぎます。 まだ他はそれを取り、リサイクルするために細胞の品質管理のチームに信号を送るcftrの折目を不適当にさせます。 そして他は蛋白質の機能と干渉しませんが、仕事をする原形質膜に得ることを防ぎます。
CuttingとGugginoの努力は、市場に出回っている二つのCF薬の設計に貢献してきました:ivacaftorとlumacaftor。 Ivacaftorは変異G551Dを有するCFTRを活性化する。 Cuttingの研究室は1990年にこの変異を最初に報告し、GugginoとCuttingはその後、CFTR機能と患者の症状に対するこの変異の影響に関する新しい洞察を生み出しました。 残念なことに、G551D変異はCF患者のわずか4%に見られます。 しかし、CF患者の50%が異なる突然変異(delta F508と呼ばれる)の2つのコピーを有しており、CFTRが形成されずに細胞のリサイクルビンに送られることが判明 Lumacaftorは原形質膜にそれを作るようにそれがリサイクルされることを防ぎます。 その後、ivacaftorはそれが動作するように必要な”キック”を与えます。
“デルタF508CFTRはまだ障害がありますが、それは何もないよりも優れています”とGuggino氏は言います。 「そして、これは私たちがもはや症状を治療するだけではないことを意味します。 私たちは根本的な原因を治療しています。”
子供が残されていません
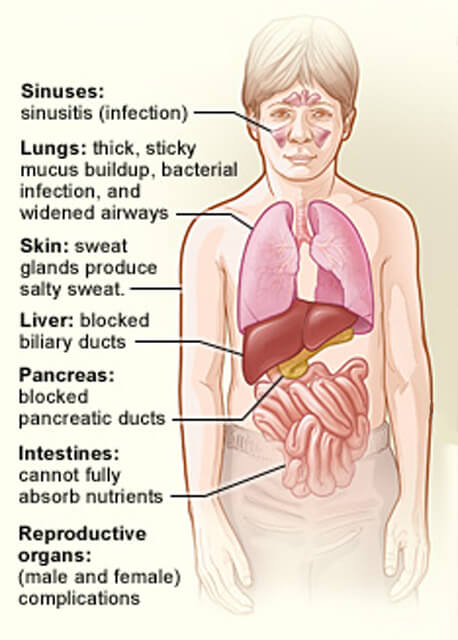 嚢胞性線維症の影響を受ける臓器。
嚢胞性線維症の影響を受ける臓器。クレジット:国立心臓、肺、血液研究所
他の変異を有するCF患者の40%以上—いくつかの非常にまれな—常に幸運ではありません。 CFTR遺伝子にはCFを引き起こす1,700以上の変異があり、承認された薬物に対する応答についてはわずかな部分のみが試験されています。 それでも、研究者は、彼らがいつか誰もが助けることができることを期待しています。 Cutting foreseesは、最終的に各患者をtheratypeによって分類し、症状の共通の根本的な原因のために同じ治療法に反応する可能性が高い患者のグループを記述するために彼が造語した言葉である。 彼は同僚のPatrick SosnayとKaren Raraighと緊密に協力して、彼の概念をテストするために世界中の88,000人の個人からのデータを採掘しています。
私たちは、CFTRの同じプロパティに影響を与えるため、CFTR薬の同じパネルに応答する必要があります変異をグループ化するために細胞で実験によっ 突然変異をtheratypeに応じてグループ化することで、一度に1つの突然変異を評価する臨床試験ではなく、異なる突然変異を有する患者の臨床試験が可能になる」とCutting氏は述べています。 “それは精密医療が現実になってきています。”
残念ながら、薬物ベースの治療法は、CFを持つすべての患者、特にCFTRを全く作らない2パーセントのために働くことはありません。 これらのために、研究者は克服すべき多くのハードルがまだありますが、変異遺伝子自体を標的とする方法を開発しています。
Gugginoは、修飾アデノ関連ウイルス(AAV)を使用して、CFTR遺伝子の良いバージョンを細胞内に沈着させる遺伝子治療システムを開発しました。 システムは人間の航空路の細胞および齧歯動物のそれ自身を証明しました。
別のアプローチを試みて、医学部のLiudmila Cebotaruは、遺伝子治療とタンパク質修復をtranscomplementationと呼ばれるメカニズムによって組み合わせる新しい方法を考案しました。 Aav内に全長CFTR遺伝子を配置する代わりに、彼女はより簡単に細胞のゲノムに挿入される短いバージョンを使用しています。 より短い蛋白質が作り出されるとき、患者の突然変異体蛋白質に結合し、原形質膜に得るのを助けます。 彼らの肺と免疫システムは人間に非常に近いので、CebotaruとGugginoの両方がアカゲザルで彼女の新しいアプローチをテストしています。 彼らは、すべてがうまくいけば、今後数年間で臨床試験を開始したいと考えています。”私はあなたの車のバッテリーをジャンプとしてそれを考えるのが好きです”と彼女は言います。 “少し余分な助けを借りて、患者のCFTRタンパク質は目的地に到達することができます。”
同様に研究者や患者のために、目的地はCFのための治療法以外の何ものでもありません。 そして、それはまだ長い道のりですが、私たちがそこに着くかもしれない励ましの兆候があります。