さて、電子密度の非局在化を考えてみましょう。 これは、電子密度が分子全体にできるだけ広がっているため、最小の電荷蓄積が与えられた軌道に存在するときです。
それは記述されています:
- ルイス構造のすべての共鳴寄与者によってまとめられています。
- 分子軌道図におけるすべての個々の分子軌道寄与によって総称される。
(これらの間には微妙な違いがありますが、これらは簡単にするためにほぼ類似しています。 詳細はこちらをご覧ください。p>
電子密度の局在化はそれの欠如です。
すべての電子密度を広げるのではなく、いくつかの軌道に詰め込むときであり、実際の分子や量子系ではほとんど
共鳴構造を持つ例
単離された(反応しない)アリルカチオン、#”C”_3″H”_5^(+)#を考えてみましょう。
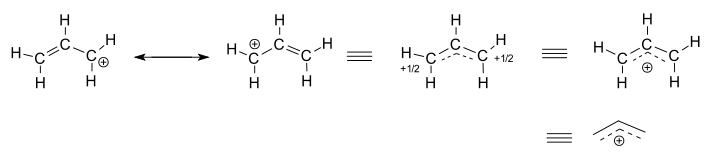
- 左の二つの構造は共鳴寄与であり、それぞれが真の非局在化構造の局在化された表現である。
- 三つの右手の構造は、それぞれ共鳴ハイブリッド構造、または非局在化構造の表現です。
非局在化構造は、基本的に結合分子軌道のコレクションによって記述されます。
分子軌道図の例
#bbpi#電子(すなわち、局在した二重結合の#pi#結合にある電子)のみを記述するMO図で再びアリルカチオンを考えてみましょう!p>
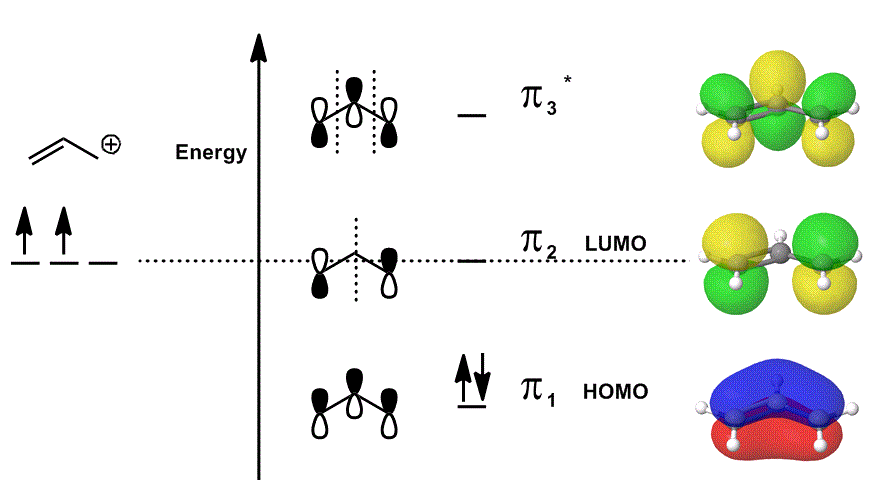
- 中央の軌道寄与はそれぞれ局在化されて描かれており、重なり合う原子軌道はそれ自体(位相を含む)として示されている。
- 右端の軌道のそれぞれ(行ごとに一つ)は非局在化されて描かれています; 電子密度は、分子軌道が重複、節および相を完全に考慮して描写されるように広がることが許される。#pi_1#、#pi_2#、および#pi_3^”*”#を重ね、これらの状態の重み付けされた寄与(係数#c_i#に従って重み付けされた)を組み込むと、分子軌道の線形結合が得られます:P>
#Psi_(“allyl”^(+))=c_1overbrace(pi_1)^”bonding”+c_2overbrace(pi_2)^”nonbonding”+c_3overbrace(pi_3^”*”)^”antibonding”#
そして#Psi_(“allyl”^(+))#その後、全体を説明しますアリルカチオンの反応性をまとめて記述する状態の分布。
言い換えれば、#pi_1#(結合に#pi#電子を寄付する)、#pi_2#(結合に電子を受け入れる)、および#pi_3^”*”#(この場合、それはめったに参加しない)すべてが、アリル陽イオンが化学反応に参加するとき、(占有されている場合)、それらは同時に存在するため、すべて何かをする。