酵素触媒作用のメカニズム
酵素の活性部位への基質の結合は非常に特 活性部位は、酵素の表面上の裂け目または溝であり、通常、折り畳まれたタンパク質の三次構造にまとめられたポリペプチド鎖の異なる部分からのア 基質は、最初に、水素結合、イオン結合、および疎水性相互作用を含む非共有結合相互作用によって活性部位に結合する。 基質が酵素の活性部位に結合すると、複数の機構が反応の生成物へのその変換を加速することができる。
前のセクションで説明した簡単な例では、単一の基質分子のみが関与していましたが、ほとんどの生化学反応は、二つ以上の異なる基質間の相互作用 例えば、ペプチド結合の形成は、2つのアミノ酸の結合を含む。 このような反応の場合、適切な位置および配向における活性部位への二つ以上の基質の結合は、反応を加速する(図2.23)。 この酵素は、反応物が一緒になり、それらが相互作用する遷移状態の形成を支持するように適切に配向される鋳型を提供する。

図2.23
二つの基質間の反応の酵素触媒作用。 この酵素は、2つの基質が互いに反応するために適切な位置および配向で一緒になっている鋳型を提供する。
酵素は、基質の立体配座を変化させて遷移状態の立体配座に近づくことによっても反応を促進する。
酵素 酵素-基質相互作用の最も単純なモデルは、基質が活性部位に正確に適合するロック-アンド-キー-モデルである(図2.24)。 しかし、多くの場合、酵素と基質の両方の配置は、基質結合によって修飾される—誘導された適合と呼ばれるプロセスである。 そのような場合、基質の立体配座は、遷移状態の立体配座とより密接に類似するように変化する。 基板のこのような歪みによって生成される応力は、臨界結合を弱めることによって遷移状態への変換をさらに容易にすることができる。 さらに、遷移状態は、酵素へのその緊密な結合によって安定化され、それによって必要な活性化エネルギーを低下させる。

図2.24
酵素-基質相互作用のモデル。 (A)ロック・アンド・キー・モデルでは、基質は酵素の活性部位に正確に適合する。 (B)誘導適合モデルでは、基質結合は基質と酵素の両方の立体配座を歪ませる。 この歪み(より。..)
複数の基質を一緒にし、遷移状態に近づくために基質の立体配座を歪めることに加えて、多くの酵素は触媒プロセスに直接関与する。 そのような場合、活性部位中の特定のアミノ酸側鎖は、基質と反応し、反応中間体と結合を形成し得る。 酸性および塩基性アミノ酸は、多くの場合、酵素触媒作用の例としてキモトリプシンの以下の議論に示されるように、これらの触媒機構に関与している。
キモトリプシンは、ペプチド結合の加水分解を触媒することによってタンパク質を消化する酵素(セリンプロテアーゼ)のファミリーのメンバーである。 反応は次のように書くことができます:

セリンプロテアーゼファミリーの異なるメンバー(キモトリプシン、トリプシン、エラスターゼ、トロンビンを含む)は、異なる基質特異性を有する; それらは、異なるアミノ酸に隣接するペプチド結合を優先的に切断する。 例えば、キモトリプシンはトリプトファンやフェニルアラニンなどの疎水性アミノ酸に隣接して結合を消化するのに対し、トリプシンはリジンやアルギニンなどの塩基性アミノ酸に隣接して結合を消化する。 すべてのセリンプロテアーゼは、しかし、構造が類似しており、触媒作用の同じメカニズムを使用します。 これらの酵素の活性部位には、セリン、ヒスチジン、アスパラギン酸の3つの重要なアミノ酸が含まれており、ペプチド結合の加水分解を促進します。 実際、これらの酵素は、セリン残基の中心的な役割のためにセリンプロテアーゼと呼ばれている。
基質は、切断部位に隣接するアミノ酸を酵素の活性部位のポケットに挿入することによってセリンプロテアーゼに結合する(図2.25)。 このポケットの性質はセリンプロテアーゼ家族の異なったメンバーの基質の特定性を定めます。 例えば、キモトリプシンの結合ポケットは、その好ましい基質の疎水性側鎖と相互作用する疎水性アミノ酸を含む。 対照的に、トリプシンの結合ポケットは、その基質のリジンまたはアルギニン残基とイオン結合を形成することができる負に帯電した酸性アミノ酸(アスパラギン酸)を含む。
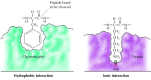
図2.25
セリンプロテアーゼによる基質結合。 切断されるペプチド結合に隣接するアミノ酸は、酵素の活性部位のポケットに挿入される。 キモトリプシンでは、ポケットは疎水性アミノ酸に結合します;トリプシンの結合ポケットは含んでいます(もっと。..)
基質結合は、活性部位セリンに隣接して切断されるペプチド結合を位置させる(図2.26)。 このセリンのプロトンは活動的な場所のヒスチジンにそれから移ります。 ヒスチジンは負に荷電したアスパラギン酸残基と相互作用するので,活性部位の立体配座はこのプロトン移動を支持する。 セリンは基質と反応して四面体遷移状態を形成する。 次いで、ペプチド結合が切断され、基質のC末端部分が酵素から放出される。 しかし、N末端ペプチドはセリンに結合したままである。 この状況は、水分子(第二の基質)が活性部位に入り、先行する反応を逆転させるときに解決される。 水分子のプロトンはヒスチジンに移され、その水酸基はペプチドに移され、第二の四面体遷移状態を形成する。 その後、プロトンはヒスチジンからセリンに戻され、ペプチドは酵素から放出され、反応が完了する。

図2.26
キモトリプシンの触媒機構。 活性部位の三つのアミノ酸(Ser-195、His-57、およびAsp-102)は、触媒作用において重要な役割を果たしています。
この例では、酵素触媒作用のいくつかの特徴を示しています。 細胞内の何千もの酵素は多くの異なる種類の化学反応を触媒するが、同じ基本原則がそれらの操作に適用される。