はじめに
化石資源はエネルギーや有機化合物の主な原料であり、その使 今後の気候変動は、石油ではなくリグノセルロース系バイオマスが燃料、化学物質、材料の生産に使用される化石ベースからバイオベースの経済への緊急の移行を求めている。 木材はリグノセルロース系バイオマスの重要な供給源です; 主にセルロース、ヘミセルロース、リグニンが豊富な二次肥厚した細胞壁で構成されています。 すべての三つのポリマーは、バイオベースの経済でvalorizedすることができます。 セルロースは、パルプおよび製紙産業のための供給源であり、セルロースおよびヘミセルロースの両方を、例えば、バイオエタノール、乳酸および界面活性剤への発酵のためにそれらの単糖類に解重合させることができる(Vanholme et al.、2013b)。 リグニンはこれらの用途に向けて木材加工の効率に悪影響を及ぼすため、木はリグニンの蓄積が少なく、紙や発酵性糖の生産に適したものになるよ 一方、リグニンはますますバイオベースの経済の貴重な成分と考えられています。 実際、リグニンが地球上で最大の再生可能な芳香族源であることを考えると、リグニンもvalorizedされ、化学物質の生産のための資源として使用される場合、 ら、2 0 0 7;Tuck e t a l., 2012; Davis et al. ら、2 0 1 3;Ragauskas e t a l. ら、2 0 1 4;Li C. ら、2 0 1 5;Van den Bosch e t a l. ら,2 0 1 5;Rinaldiら,2 0 1 5;Rinaldiら, ることができる。, 2018).
リグニンポリマーは、フェニルプロパノイドとモノリグノールの生合成経路によって生成されるモノリグノールから構成され、フェニルアラニンの脱アミノ化から始まる一連の酵素反応によって構成されている(図1)。 モノリグノールは細胞質内で合成され、アポプラストに移動し、そこでラッカーゼおよびペルオキシダーゼの作用によってモノリグノールラジカルに脱水素される(Berthet et al. ら、2 0 1 1;Zhao e t a l., 2013). これらのモノリグノールラジカルは、その後、組み合わせ式で互いに結合し、アリール-エーテル結合(β-O-4)、レジノール結合(β-β)、およびフェニルクーマラン結合(β-5)のような化学結合の範囲を生成する(Boerjan et al. ら、2 0 0 3;Ralph e t a l. ら,2 0 0 4;Vanholme e t a l., 2010). H、G、およびS単位をそれぞれ生成する(BonawitzおよびChapple,2 0 1 0;Ralph e t a l. ら、2 0 1 9;Vanholme e t a l., 2019). 針葉樹(裸子植物)からのリグニンは、h単位のわずかな画分を持つG単位のほぼ完全に構成され、広葉樹(被子植物)からのリグニンは、G単位およびh単位の痕跡に加えてS単位を有する(Boerjan et al. ら,2 0 0 3;Vanholme e t a l., 2010, 2019). これらの伝統的なモノリグノールの他に、様々な他のp−ヒドロキシル化芳香族分子を、リグニン重合体中に様々なレベルまで組み込むことができる(Vanholme e t a l., 2019).
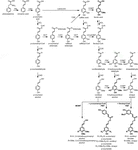
Figure 1. Lignin biosynthetic pathway. Alternative monomers and heterologously expressed enzymes are shown in bold. PAL, phenylalanine ammonia-lyase; C4H, cinnamate 4-hydroxylase; 4CL, 4-coumarate:CoA ligase; HCT, p-Hydroxycinnamoyl-CoA:quinate/shikimate-p-hydroxycinnamoyltransferase; C3’H, p-coumaroyl quinate/shikimate 3’-hydroxylase; CSE, caffeoyl shikimate esterase; CCoAOMT, caffeoyl-CoA O-methyltransferase; CCR, cinnamoyl-CoA reductase; F5H, ferulate 5-hydroxylase/CAld5H, coniferaldehyde 5-hydroxylase; COMT,caffeic acid O-methyltransferase;CAD,cinnamyl alcohol dehydrogenase;FMT,feruloyl-CoA monolignol transferase;PMT,p-coumaroyl-CoA monolignol transferase.
リグニンが木材脱リグニン過程における主要な反抗因子であることを考えると、リグニン生合成経路を解明し、リグニン生合成遺伝子の摂動がリグニンの量と組成、および木材加工効率に及ぼす影響を研究するために大規模な研究が行われている。 転写因子をコードするものから酸化酵素をコードするものまでの範囲の遺伝子の改変は、リグニン含量、組成または沈着の変化をもたらしたが(Eriksson e t a l. ら,2 0 0 0;Li Y. ら、2 0 0 3;Liang e t a l. ら、2 0 0 8;Lu e t a l. ら、2 0 1 3;Lin e t a l. 2016年;Xu,et al. ら、2 0 1 7;Yang e t a l. ら、2 0 1 7;Obudulu e t a l. このレビューでは、リグニン生合成遺伝子を設計することによって得られた結果に焦点を当てます。
リグニン経路のエンジニアリング
表1は、ポプラ、松、ユーカリ、シラカバにおけるダウンレギュレートまたは変異リグニン生合成遺伝子に関する異なる研究の概要を示し、木材加工効率に及ぼす影響を決定した場合。 PALからCADまでのリグニン生合成経路の任意の工程の活性を低下させることは、リグニン含量の低下をもたらす可能性がある(表1)。 いくつかのパラメータは、標的遺伝子と順番に使用されるサイレンシング構築物の効率、遺伝子ファミリーのサイズ、および遺伝子ファミリー内の冗長性に依存する酵素活性のダウンレギュレーションの程度など、リグニンの減少の程度に影響を与えます。 一般に、C4HからCCRまでの工程の下方制御は、リグニン量のより劇的な減少をもたらす(H U e t a l. ら、1 9 9 9;Meyermans e t a l. ら、2 0 0 0;Zhong e t a l. ら,2 0 0 0;Li L. ら,2 0 0 3;Jiaら,2 0 0 4;J. ら、2 0 0 4;Lu e t a l. ら、2 0 0 4;Leple e t a l. ら、2 0 0 7;Coleman e t a l. ら,2 0 0 8a,b;Bjurhagerら,2 0 0 8a,b., 2010; マンスフィールド他 ら、2 0 1 2;Ralph e t a l. ら,2 0 1 2;Minら,2 0 1 2;Minら, ら、2 0 1 4;Van Acker e t a l. ら、2 0 1 4;Zhou e t a l. ら,2 0 1 5,2 0 1 8;Salemeら,2 0 1 8,2 0 1 9. ら、2 0 1 7;Xhang e t a l. ら、2 0 1 7)F5H、COMTおよびCADのダウンレギュレーションよりも(Van Doorsselaere e t a l. ら、1 9 9 5;Baucherら、1 9 9 6;B. ら、1 9 9 6;Lapierreら、1 9 9 7;L. ら、1 9 9 9;Jouanin e t a l. ら、2 0 0 0;Van Acker e t a l. ら、2 0 1 4;Wang e t a l., 2018). リグニンの減少は、C3’H−のようなS/Gの増加に関連し得る(Coleman e t a l. ら、2 0 0 8a;Ralph e t a l. ら、2 0 1 2)およびCcoaomt−下方制御された木(Meyermans e t a l. ら、2 0 0 0)、またはCS E−のようなS/G比の低下(Saleme e t a l. ら、2 0 1 7)、およびCOMT−下方制御された木(Van Doorsselaereら、2 0 1 8)。 ら、1 9 9 5;Lapierreら、1 9 9 6;L. ら、1 9 9 9;Jouanin e t a l., 2000). 興味深いことに、低リグニン4CL−下方制御ポプラは、S/Gの増加を有することが見出された(Min e t a l. ら、2 0 1 4;Xhang e t a l. ら、2 0 1 7)、S/Gの減少(Voelker e t a l. ら、2 0 1 0;Zhou e t a l. ら、2 0 1 5)、または野生型に匹敵する比(H U e t a l. ら、1 9 9 9;Li L., 2003). この分散は、プロモーターまたはサイレンシング、成長条件または発達状態の程度の違いは、この形質に影響を与えることを示唆し、ダウンレギュレーション 一方、H/G/Sリグニン組成に対する最も強い効果は、H単位含有量の大きな増加とリグニンを堆積させるC3’HおよびHCTでダウンレギュレートされた木 ら、2 0 0 8a;Ralph e t a l. ら、2 0 1 2;Vanholme e t a l. ら、2 0 1 3a)、一方、F5Hを過剰発現する樹木は、S単位で強く富化されたリグニンを産生する(Franke e t a l. ら,2 0 0 0;Li L. ら,2 0 0 3;Stewart e t a l. ら、2 0 0 9)、およびCOMTで下方制御されている樹木は、S単位の生合成を劇的に減少させている(Van Doorsselaere e t a l. ら、1 9 9 5;Lapierreら、1 9 9 6;L., 1999).テーブル1

テーブル1。 リグニン生合成遺伝子の発現を改変した森林樹木の概要。バイオマスの処理効率は、一般的に野生型植物のリグニン中のマイナーな成分を表す分子の増加した取り込みによっても変更することができる。
バイオマスの処理効率は、一般的に野生型植物のリグニン中のマイナーな成分を表す分子の増加によっても変更することができる。 CCR欠損木におけるフェルラ酸の取り込みは、酸性バイオマス前処理中で容易に切断されるリグニンポリマー中のアセタール結合の形成をもたらす(Leplé et al. ら、2 0 0 7;Ralph e t a l. ら、2 0 0 8;Van Acker e t a l., 2014). 実際、リグニン中のフェルラ酸のレベルは、より高い糖化効率と正の相関を示した(Van Acker e t a l., 2014). COMT欠損ポプラのリグニン中の5−ヒドロキシコニフェリルアルコールおよび5−ヒドロキシコニフェルアルデヒドの取り込み(Van Doorsselaere e t a l. ら、1 9 9 5;Lapierreら、1 9 9 6;L. ら、1 9 9 9;Jouanin e t a l. ら,2 0 0 0;Morreelら. ら、2 0 0 4;Lu e t a l. ら、2 0 1 0)は、ベンゾジオキサン結合を生じさせ、リグニンと多糖類の水酸基との間の共有結合を潜在的に防止する(Weng e t a l.,2 0 1 0)。 ら、2 0 1 0;Vanholme e t a l. 2012年、西村ら。, 2018). 一方、COMT欠乏はまた、s単位周波数が低下すると、凝縮β-βおよびβ-5結合の比較的高いレベル、およびβ-O-4結合の低いレベルのために、より凝縮リグニン COMTに対して強くダウンレギュレートされたポプラ由来の木材の化学パルプ化は,パルプ中の残留リグニン含量によって相殺されるより高いパルプ収率をもたらした。 これらの木は、より低いリグニンおよびより高いセルロース含量を有していた(Jouanin et al., 2000). 一方、COMTのために適度にダウンレギュレートされたポプラは、リグニン含有量が正常なままであったが、リグニンはリグニン抽出に悪影響を及ぼす凝縮結合の頻度が高かったため、パルプ収率が大幅に低下した(Lapierre et al. ら、1 9 9 9;Pilateら、1 9 9 9;Pilateら、, 2002). CAD欠損木におけるリグニンポリマー中のシンナムアルデヒドの取り込みは、より短いリグニンポリマー鎖をもたらし、したがって、アルカリ中のポリマーの溶解性を増加させる遊離フェノール末端基の割合が高い。 リグニンポリマー中のシンナムアルデヒドの取り込みは、おそらくまた、再びリグニンをより可溶性にする、ヘミセルロースと脂肪族鎖の共有結合相互作用を減少させます。 さらに、シンナムアルデヒドβ-O-4が別の単量体と結合するときに生成される拡張共役系のために、組み込まれたシンナムアルデヒドの芳香族エーテル結合は、アルカリ開裂の影響を受けやすくなる(Lapierre et al. ら、1 9 8 9;Van Acker e t a l., 2017).
リグニン重合は、組合せラジカル結合プロセスであり、広範囲のフェノール化合物をリグニン重合体に自然に組み込むことができる(Boerjan et al. ら,2 0 0 3;Vanholme e t a l., 2019). 研究者らは、異種遺伝子の発現によるバイオマス処理を改善するためにリグニンの量および組成を調整することを試み、リグニンポリマーへの代替モノリグノールとしての様々な互換性のあるフェノール化合物の生合成および取り込みを目的としている(Ralph,2006;Vanholme et al. ら、2 0 1 2;Mottiar e t a l. ることを示した。 1つの例は、マツにおけるS単位生合成に必要な酵素をコードする遺伝子の導入であり;F5H、COMTおよびCADの同時発現は、マツにおけるs単位の導入に成 ら、2 0 1 5;Edmundsら、2 0 1 6;Smith e t a l., 2017). ポプラにモノリグノール4-O-メチルトランスフェラーゼ(MOMT4)をコードする遺伝子を導入すると、4-O-メチル化コニフェリルおよびシナピルアルコールが形成され、芳香族ヒドロキシル基がないため、成長するリグニンポリマーに組み込むことができない。 これは、リグニン重合の停止をもたらし、より低いリグニン含量およびより高い糖化効率を有する樹木をもたらす(BhuiyaおよびLiu、2010;Cai et al., 2016). ポプラはまた、リグニンポリマー骨格にエステル結合を含むように設計されている。 Angelicasinensis由来のフェルロイル-Coa:モノリグノールトランスフェラーゼ(FMT)遺伝子の発現を介してコニフェリルフェルレートエステルをポリマーに導入した(Wilkerson e t a l. ら、2 0 1 4)、種々の前処理条件下での糖化効率の改善につながる(Wilkerson e t a l.,2 0 1 4)。 ら、2 0 1 4;Kim e t a l. ら、2 0 1 7;Bhalla e t a l. ら,2 0 1 8)、および野生型と比較して改善されたクラフトパルプ化効率(Zhou e t a l.,2 0 1 8)、および野生型と比較して改善され, 2017). Pmt遺伝子の発現を介して、より高い頻度の耐性ユニット間結合およびより高い頻度の遊離フェノール基を有するGおよびS末端単位を生じる(Smith e t a l. ら、2 0 1 5;Sibout e t a l., 2016). シロイヌナズナでは、PMTの異種発現は、糖化効率の増加を伴うリグニン量の減少をもたらした(Sibout e t a l. ら、2 0 1 6)、ポプラ中のリグニン量の減少はなく、糖化効率は決定されなかった(Smith e t a l.,2 0 1 6)。, 2015).
リグニンの量と組成のいくつかの変更は、バイオマス処理の改善を提供することが示されたが、これらの変更は、多くの場合、バイオマス収率のペ ら、2 0 0 7;Wadenback e t a l. ら、2 0 0 8;Wagner e t a l. ら、2 0 0 9;Voelker e t a l. ら、2 0 1 0;Stout e t a l. ら、2 0 1 4;Van Acker e t a l. ら、2 0 1 4;Sykes e t a l. ら、2 0 1 5;Zhou e t a l., 2018). 最近のmetastudyはPの21のリグニンの生合成の遺伝子を摂動させた。 trichocarpa、および包括的に221ラインのtranscriptomic、proteomic、fluxomic、およびphenomicデータの結果を統合しました。 著者らは、樹木の成長は、リグニン量、サブユニット組成または特異的な結合と関連していないと結論付けた(Wang et al. ら、2018)、むしろ崩壊した木部容器の存在と相関している(Colemanら、2018)。 ら,2 0 0 8a,b;Wagnerら,2 0 0 8a,b;Wagnerら, ら、2 0 0 9;Voelker e t a l. ら、2 0 1 0;Vargas e t a l. ら、2 0 1 6;De Meester e t a l. ら、2 0 1 8)、細胞壁完全性経路の活性化(Bonawitz e t a l. ら、2 0 1 4)および/または化学阻害剤の蓄積(Gallego−Giraldo e t a l., 2011; Muro-Villanueva et al., 2019).
リグニン生合成遺伝子のダウンレギュレーションによってリグニン含量を減少させるためのかなりの努力がなされているが、リグニン経路のアップレギュレーションとリグニンの過剰産生に関する研究は乏しい。 実際に、F5Hの過剰発現に関する報告は、リグニン含量の変化しないか、または減少さえも示す(Huntley e t a l. ら、2 0 0 3;Li L. ら,2 0 0 3;Stewart e t a l. ら、2 0 0 9;Mansfield e t a l. ら、2 0 1 2;Edmunds e t a l., 2017). CADおよびCOMTの過剰発現は、上方制御よりもむしろ遺伝子サイレンシングをもたらしたか、または発現レベルに対する影響は検出されなかった(Baucher e t a l. ら、1 9 9 6;Lapierreら、1 9 9 7;L. ら、1 9 9 9;Jouanin e t a l. ら、2 0 0 0;Lepleら、2 0 0 1)。 ら、2 0 0 7;Van Acker e t a l., 2014). R2R3-MYB転写因子Ptomyb92、Ptomyb216、およびPtomyb74の過剰発現は、すべて追加の木部層、厚い木部細胞壁だけでなく、異所性リグニン沈着をもたらし、植物は13-50%より多くのリグニンを蓄積した(Tian Q.et al. ら、2 0 1 3;Li C. ら,2 0 1 5;Liら,2 0 1 5;Liら,, 2018). MYB過剰発現ラインは構成的にリグニン生合成経路遺伝子をアップレギュレートし、MYB92とMYB74を過剰発現植物はバイオマスペナルティを持っていたが、MYB216の過剰発現は、最大50%以上のリグニンと無発達表現型を持つ植物をもたらした。 リグニンはますます化学物質の持続可能な生産のための重要な資源と考えられているように(Cao et al. リグニンを過剰生産する植物の工学はさらに検討されるべきである。
フィールドトライアル
上記の例は、フェニルプロパノイド経路遺伝子のダウンまたはアップレギュレーションを介してリグニン工学 実用的および規制上の理由により、ほとんどの研究は、温室内で栽培された樹木の分析から得られたデータについて報告している。 しかし、温室内で栽培された樹木を用いた実験では、通常、成長の停止や休眠などの発達過程を考慮していません。 さらに、温室実験では、設計された植物と土壌の種類、風、病原体などの環境要因との相互作用について十分な洞察が得られません。 これらの相互作用を理解することは、研究成果を商用アプリケーションに翻訳する上で重要なステップです。 実際、フィールドトライアルを確立する許可が与えられた研究によって生成された作業の本体は、温室と畑で栽培された木の間の表現型の重要な違いを強調しています。 表1は、4CL、CCoAOMT、CCR、COMT、およびCADダウンレギュレートされたツリーで実行されたフィールドトライアルに関するレポートをまとめたものです。
適用のための基質として変更されたlignocellulosic生物量の潜在性を確認して、複数のlignin設計された実地試験成長させた木は木処理の改善を示しました。 北京(中国)での実地試験で5年間成長させたCcoaomtのためにダウンレギュレートされたポプラは、糖化時にグルコースおよびキシロース放出の増加を示した(Wang e t a l., 2012). ポプラは、CCRのために下方制御され、フランスでの野外試験で栽培され、化学クラフトパルプ化により従順であることが証明された(Leplé et al., 2007). CCRダウンレギュレートポプラを用いてフランスとベルギーで実施された二つの追加のフィールド試験は、同時糖化と発酵(SSF)アッセイにおけるエタノール生産の160%の改善をもたらした;しかし、植物は最大50%のバイオマス削減を持っていた(Van Acker et al., 2014). CADダウンレギュレートポプラを用いた実地試験も有望な結果を示した。 これらの木は野生型よりもわずかに少ないリグニンを示し、クラフト脱リグニン化に対してより従順であることが証明された(Lapierre et al., 1999). 一貫して、フランスと英国の大規模なフィールド試験で栽培された同じラインは、野生型の木と同様の脱リグニン化を達成するために6%少ないアルカリを必要としたため、リグニン量の軽度の減少と商業的に関連すると考えられるクラフトパルプ化の改善を示した(Pilate et al., 2002).
しかし、バイオマス収量と下流の処理効率の両方に関する矛盾する報告は、これらのパラメータが環境要因の影響を強く受けることを示唆している。 4CLの下方制御されたポプラを用いて中国で実施された実地試験では、野生型と比較してリグニン含量が28%減少しても、樹木の高さは約8%増加してい ら、2 0 1 3)、温室効果研究と一致する(H U e t a l. 1999)、他のフィールド試験では、4CLダウンレギュレートされたポプラはバイオマスを減少させ、時には矮小化されることさえあることが分かった(Voelker et al. ら、2 0 1 0;Stout e t a l., 2014; Marchin et al., 2017). 報告はまた、これらの4CLダウンレギュレートされたフィールド栽培ポプラから派生した木材の下流の処理効率に関する発散する。 糖回収率の最大100%の増加は、米国の山のサイトで栽培された4CL1ダウンレギュレート木(35s駆動アンチセンス4CL構築物)のために発見されたが(Xiang et al. ら、2 0 1 7)、Oregon(米国)で実施された野外研究から得られたデータは、pt4Cl1プロモーター駆動アンチセンス沈黙4CL1ポプラが野生型と比較して糖化効率の改善を有, 2010). 同様に、温嶺(中国)での長期研究では、4CL下方制御ポプラが野生型と比較して糖収量に有意な改善を示さなかったことが見出された(Wang e t a l., 2012). 後者の両方の場合において、木は、潜在的に酵素活性を妨害する可能性のある抽出物の高濃度のために、より高い処理効率に翻訳されなかったリグニン量の軽度の減少を示した(Voelker e t a l., 2010).
フィールドトライアル研究は、環境要因が同じ植物が温室内で栽培されたときに達成されたレベルと比較して、木質化に影響を与え、野生型レベ 4CLダウンレギュレートされた木は、温室条件下で栽培されたときにリグニン含有量を減少させていたが、同じ4CLアンチセンスポプラの分析は、多くの場合、リグニン含有量は、温室栽培の木と比較して増加し、時には野生型レベルに復元されたことを示している(Stout et al. ら、2 0 1 4;Xhang e t a l., 2017). 同様に、リグニンレベルは、温室内で成長させたときと比較して、野外で成長させたときに、CCR欠損ポプラにおいてはるかに減少しなかった(Van Acker e t a l., 2014). 少なくともCCR欠損ポプラについては,圃場栽培木のより高い木質化レベルは,木材サンプルが冬の間に採取されたという事実によるものである可能性がある。 秋に木の成長が止まると、木はまだ新しい木部を継続的に開発する温室栽培の木と比較して、木が休眠に入るまでに細胞壁を完全に木質化する時間 リグニン組成はまた、温室と畑で栽培された低リグニンの木の間で異なることが示されている。 ノースカロライナ州の畑で栽培された4CL-下方制御ポプラは、同じ系統が温室で栽培されたときよりも低いS/Gを有するリグニンを有していた(Stout et al., 2014).
まとめると、これらの結果は、温室栽培の木から得られたデータを畑栽培の木に簡単に外挿することができないことを示しており、異なる場所での いくつかの行は、収量ペナルティの分子基盤のより良い理解とこの問題を克服するための戦略の開発の必要性を強調し、アプリケーションのためにそ
リグニンは病原体抵抗性において重要な役割を果たすことが示されている(Miedes et al.,2014;Zhao and Dixon,2014)、そしてそれは植物が水を輸送することを可能にする上で極めて重要な役割を果たしています。 これは、リグニン修飾が植物のストレス耐性に影響を与える可能性があることを示唆している。 この可能性に完全に対処するためにさらなる調査が必要であるが、ポプラ中の4CL、COMT、およびCADの下方制御は、葉摂食草食動物の摂食性能を劇的に変化させなかった(Tiimonen et al. ら,2 0 0 5;Brodeur−Campbell e t a l. ら,2 0 0 6;Hjalten e t a l., 2013). ポプラにおけるCOMTおよびCADのダウンレギュレーションが植物-昆虫相互作用に及ぼす影響も畑で栽培された樹木で評価されており、リグニン修飾された樹木は、微生物病原体に対する正常な応答と同様に、昆虫を訪問および摂食する正常な発生率を有することが示された(Pilate et al., 2002; Halpin et al., 2007). これらの結果は,修飾リグニンを有する樹木は必ずしも野生型植物よりも害虫や病気に苦しむとは限らないことを示している。 それにもかかわらず、フィールド栽培、CCRダウンレギュレートされたポプラから収穫された木材の内層細菌microbiomeのプロファイリングは、おそらく木部の特定のフェノール代謝産物の変化した豊富さのために、細菌のコミュニティのシフトを示した(Beckers et al., 2017).
木部の機能と構造におけるリグニンの役割を考慮して、いくつかの低リグニン修飾ポプラの水関係を評価しました。 4CL−下方制御されたポプラは、潜在的に植物の成長を妨害する、水理伝導率を低下させることが見出された(Marchin e t a l., 2017). CCR、COMTまたはCADのためにダウンレギュレートされたポプラを用いた水理応力実験は、これらの植物が正常な木部の水理伝導性および水輸送を維持しながら、, 2012). これらの結果から,低リグニン変異体の成長は水の利用可能性に影響されることが示唆された。 古典的な育種から得られた新しいハイブリッドについては,リグニン工学木の圃場性能と応力耐性を評価するためにフィールドテストが必要である。
森林樹木におけるリグニン工学の見通し
リグニン工学植物の性能は、環境条件によって大きく影響されるようである。 しかし、温室栽培と畑栽培の木の間で観察された違い、または異なるフィールドの場所で栽培された木の間で観察された違いは、遺伝子抑制の異なるレベ 実際、不安定なダウンレギュレーションは、Rnaiに基づく遺伝子サイレンシング技術の欠点である。 これは、CAD、COMT、またはCCRなどの特定のリグニン生合成遺伝子がダウンレギュレートされているときに観察される赤い木部表現型の変化を観察することに 赤い木部の着色は、しばしば木部全体にわたって均一ではなく、むしろ遺伝子サイレンシングの可変レベルを反映するパッチに現れる(Leplé et al. ら、2 0 0 7;Voelker e t a l. ら、2 0 1 0;Van Acker e t a l.,2014;図2). さらに、遺伝子サイレンシング法の使用は、潜在的に密接に関連する遺伝子ファミリーメンバーの同時サイレンシングをもたらす可能性があります–おそ

図2。 RNAiによる斑状遺伝子のダウンレギュレーション。 ベルギーのフィールドトライアルで栽培されたCCR欠損ポプラ(右)のトランクに見られる斑状の赤い木部の表現型。 赤い木部は、CCRダウンレギュレーションの領域を示します。 野生型の木からの木は白っぽいです(左)。
これらの問題は、特定の標的遺伝子における安定した機能喪失変異(ノックアウト)を可能にし、家族内の個々の遺伝子の機能の解剖を可能にするCRISPRベースの遺伝子編集技術を使用することによって容易に克服することができるようになった。 例えば、ポプラ中の個々の4CL遺伝子ファミリーメンバーの標的化は、4CL1が木質化に関連しているのに対し、4CL2がプロアントシアニジン産生に関与していることを示した(Zhou et al., 2015). ノックアウト対立遺伝子に加えて、CRISPRベースの遺伝子編集はまた、酵素活性の部分的な減少を付与する新しい対立遺伝子を作成することを可能にする。 これは、残留酵素活性のレベルを微調整し、リグニン量が閾値レベルを下回ったときにしばしば観察される収率ペナルティをバイパスする可能性を開 例えば、シロイヌナズナでは、トランスアルドラーゼ(tra)とcomt変異、c4hとcomt変異、または4clとcomt変異のスタッキングが糖化効率の相加的および相乗的な改善をもたらした(de Vries et al., 2018). 確かに、システムはPでアプローチします。 trichocarpaは、PALおよびCcoaomt、またはPAL、C3’HおよびCCOAOMTの付随する下方制御が、木材特性および糖放出を実質的に改善すると予測している(Wang e t a l., 2018).
この技術を他の育種技術と戦略的に組み合わせることで、CRISPRベースのゲノム編集をパルプ-紙およびバイオ精製産業の樹木改良に使用し、リグニンの水素分解分解からプラットフォーム芳香族化合物の製造に使用することが最も価値があります(図3)。 実際に、リグニン量およびS/G組成の大きな変動は、森林樹木の自然個体群に既に存在する(Studer e t a l., 2011). 両方の形質が糖化時のグルコース放出に影響することを考えると(Yoo et al. この遺伝的多様性を従来の育種によって利用し、Genome Wide Association Studies(GWAS)によって支援されている(Porth e t a l.,2 0 1 8)。 ら、2 0 1 3;Fahrenkrog e t a l. ら、2 0 1 7;Liu e t a l. ら、2 0 1 8)、希少欠損対立遺伝子(BRDA)を用いた繁殖(Vanholme e t a l. ら、2 0 1 3a)またはゲノム選択(Yin e t a l. ら,2 0 1 0;Muchero e t a l. ら、2 0 1 5;Pawar e t a l. ら、2 0 1 8;Xie e t a l.,2018)は、木材加工効率を向上させたラインを得るための貴重な戦略です。 エリートツリーは、これらの育種方法によって取得されると、遺伝子工学と特定の遺伝子のCRISPRベースの遺伝子編集は、さらに彼らの遺伝的構成を分割するこ 差し迫った気候のクラッシュを考えると、私たちはバイオベース経済への私たちのレースでこれらの新しい繁殖技術を採用することに失う時間はもう
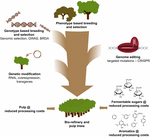
図3. 育種ツールの組み合わせによる森林の木の遺伝的改善。 パルプおよび生物精製の適用のための森林木の遺伝の改善を加速するためには、古典的で、新しい繁殖用具は活発に結合される必要があります。 古典的な繁殖は、表現型の選択に続いて、制御された十字架のための木の表現型の選択を含みます。 多くの森林樹木のゲノム配列情報の出現により、ゲノム選択、ゲノムワイドアソシエーション研究(GWAS)、まれな欠陥対立遺伝子(BRDA)による育種などの新しい戦略は、有益な形質に関連するDNA多型の捕捉と濃縮をスピードアップするために開発されている。 CRISPRベースのゲノム編集は、自然の多型を模倣する方法でゲノムを変更することができます。 遺伝子改変は、(an)酵素(複数可)を過剰生産するか、(a)遺伝子(複数可)をダウンレギュレートするために、ツリーに外来DNAの安定した統合を含みます。 社会に十分な高品質の木材を提供するためには、古典的な技術と新しい育種技術を組み合わせる必要があります。
著者の貢献
リストされているすべての著者は、仕事に実質的な、直接的かつ知的な貢献をし、出版のためにそれを承認しました。
資金調達
私たちは、IWT-SBOプロジェクトBIOLEUM(助成金第130039号)からの部分的な資金、およびARBOREFプロジェクトを通じてSBO-FISHによる資金調達を認めています。 ACは、Marie Skłodowska-Curie Grant Agreement No.665501の下で、Fwoと欧州連合のHorizon2020Research and Innovationプログラムから資金を受けています。 LdVは、博士前期フェローシップのためにフランダースの科学技術を通じたイノベーション推進研究所(IWT-Vlaanderen)によって資金を供給されました。
利益相反に関する声明
著者らは、この研究は、利益相反の可能性と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。この原稿を提出するために準備してくれたAnnick Bleysに感謝します。
謝辞
この原稿を提出するために準備してくれたAnnick Bleysに感謝します。
Boerjan,W.,Ralph,J.,And Baucher,M.(2003). リグニン生合成。 アンヌ 植物生物学者。 54, 519–546.Pubmed Abstract|Google Scholar
Lapierre,C.,Pollet,B.,Petit-Conil,M.,Toval,G.,Romero,J.,Pilate,G.,et al. (1999). シンナミルアルコールデヒドロゲナーゼまたはカフェ酸O-メチルトランスフェラーゼ活性の低下を伴うトランスジェニックポプラにおけるリグニンの構造変化は、産業クラフトパルプ化の効率に反対の影響を与える。 植物フィジオール。 119, 153–163.PubMed Abstract/Google Scholar
Ralph,J.(2006). “何が良いモノリグノールの代替になりますか?、”植物細胞壁の科学と伝承–生合成、構造と機能、編。 林哲夫(はやしてつお、FL:BrownWalker Press)は、日本の漫画家。