米国Pharm。 2008;33(4)(腫瘍学suppl):20-30.
概要:乳癌を有する閉経後女性の約75%がホルモン受容体陽性(HR+)疾患を有する。1つのTamoxifenはanastrozole、letrozoleおよびexemestaneの選択的な第三世代のaromataseの抑制剤の出現までpostmenopausal女性のHR+の乳癌のための療法の標準でした。3,4これらの薬剤はTAMOXIFENと比較される臨床試験の優秀な無病の存続を示しましたがHR+乳癌のpostmenopausal女性で5年以上に使用されたとき利点は確立されません。3,4
乳がんを有する閉経後女性の四分の三は、ホルモン受容体陽性(HR+)疾患を有すると推定されている。1つのTamoxifen–骨に対するestrogenic効果の選択的なエストロゲン受容器の変調器、endometrialティッシュおよび脂質および反!=胸のティッシュに対するestrogenic効果–選択的な第三世代のaromataseの抑制剤(AIs)の導入までのpostmenopausal女性のHR+の乳癌のための標準的な療法はありました。2-4これらの代理店–anastrozole、letrozoleおよびexemestane–臨床試験のtamoxifenと比較される優秀な無病の存続(DFS)を示しました。3,4タモキシフェンの使用に関連する悪影響-子宮内膜癌、血栓塞栓合併症、およびタモキシフェン耐性-は、AIsなどの異なる作用機序を有する治療法の開2
第三世代AIsに関する重要な情報の概要については、表1を参照してください。
背景
スコットランドの外科医ジョージ-ビートソンは、1896年5月に乳癌に関連して発癌に対するエストロゲンのホルモン…..5この外科的に誘発されたエストロゲン欠乏状態は、HR+疾患を有する女性の乳癌細胞における腫瘍増殖の阻害に寄与した。5
Aminoglutethimideは、もともと抗けいれん剤として処方され、1970年代後半に高度なHR+乳癌を有する閉経後女性のためのタモキシフェンに続く第二選択剤として最初に推進された最初の非特異的なAIであった。6副腎抑制などの毒性副作用やステロイド療法の必要性により、アミノグルテチミドは市場から撤退した。6早期および後期のHR+乳がんを有する閉経後女性において、第3世代AIsは、より古い薬剤と比較して、より優れた毒性プロファイル、より多くの選択性、 6
Classification4,7
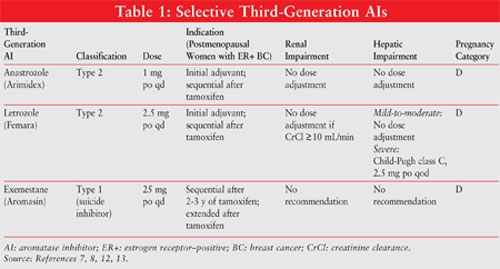
AIsは、1型ステロイド(非競合的、不可逆的)または2型非ステロイド(競合的、可逆的)阻害剤として分類される。 Exemestaneのタイプ1の抑制剤はaromataseの分子の場所に、不可逆的に結合し、自殺の抑制剤として知られています。 タイプ2の抑制剤anastrozoleおよびletrozoleはaromataseに可逆的に結合します。 異なるAIsの化学構造については、図1を参照してください。 /p>
アクションのメカニズム
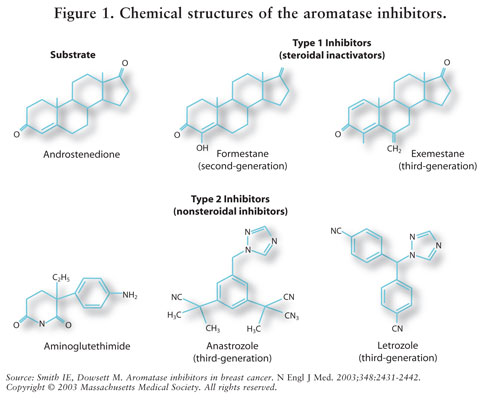
エストロゲンの統合は酵素のaromataseによって仲介されます。7つのAromataseはestroneおよびestradiolにandrostenedioneおよびテストステロンを変えます。5,7AIsはそれにより胸のティッシュに対する発癌性の効果を禁じるpostmenopausal女性のエストロゲンを、減らします。7premenopausal女性の卵巣がまだ作用しているので、AIsは臨床試験の外のこの人口のために示されません;これらの女性では、aisは性腺刺激ホルモンの生産を増4図2を参照してください。
Aisの毒性6,8
aisの有害作用には、高血圧、血管拡張、浮腫、胸痛などの心血管機能障害が含まれる。 心機能に対するAIsの完全な効果を評価するためには、さらなる研究が必要である。 患者は減らされた骨のミネラル密度(BMD)、ひびの高められた危険、vasomotor徴候、腟の乾燥、musculoskeletal苦痛、頭痛、不眠症、不況、高められた咳、呼吸困難、胃腸不快、体重増加および多分 骨の損失は優勢な副作用です;zoledronic酸のようなbisphosphonatesがそれを妨害するのに使用されていました。 AIsの患者はビタミンDおよびカルシウム補足を受け取るべきです。 AI療法による長期にわたる悪影響および認知機能への影響はまだ決定されていない。9AIsは妊婦には禁忌である。
薬物相互作用
AnastrozoleはCYP1A2、CYP2C9、およびCYP3A4.10,11を阻害するLetrozoleはCYP2A6およびCYP2C19によって代謝され、exemestaneはcyp3A4.8,10-13リファンピン、フェニトイン、カルバマゼピン、セントジョンズワートなどのCYP3a4の誘導物質を代謝し、同時に与えられたときにexemestaneレベルの低下を引き起こす可能性がある。 共同管理されたとき8,12,13Tamoxifenによりletrozoleの38%の減少およびanastrozoleの27%の減少を引き起こします。2,7,8,14
適応症および投与
Anastrozole10,11:Anastrozole1mgは、ホルモン感受性疾患を有する閉経後女性における初期補助療法として、およびHR+またはHR-未知の転移性または局所的に進行した疾患の最初の行として、早期乳癌に対して示される。 それはまた進歩的な病気の女性のtamoxifen療法に続く使用のために承認されます。 用量調整は、腎障害または軽度から中等度の肝障害のために必要とされません。
Letrozole11,12:Letrozole2.5mgは最初の療法またはtamoxifenの後の延長アジュバント療法としてHR+の早期乳癌のpostmenopausal女性のために毎日一度示されます。 それはまたHR+またはHR-未知のmetastatic病気のために示されます。 重度の肝障害には用量調整が推奨される。
Exemestane11,14:Exemestane25mg poはホルモン性療法の五年連続した合計のためのHR+早い乳癌のpostmenopausal女性のためのtamoxifenに続く二から三年 それはまたtamoxifen療法の後で進歩した病気に使用するかもしれません。 それは食事の後に取られるべきです。 用量調整は、肝または腎障害のために不要です
臨床試験
子宮内膜癌などのタモキシフェン関連毒性は、HR+乳癌を有する閉経後 様々な試験設計は、タモキシフェンと比較して、これらの薬剤の性能を評価するために使用されました。6臨床的有効性および毒性プロファイルの面で優れたアウトカムは、HR+乳癌を有する閉経後女性における補助療法の新しい標準としてAIsを確立した。6
ATAC15:ATAC(Arimidex,タモキシフェン単独または組み合わせで),多施設,無作為化,二重盲検研究,3つの治療アームを比較:タモキシフェン20mg+アナストロゾールプラセボ,アナストロゾール1mg+タモキシフェンプラセボ,とタモキシフェンの組み合わせ20mg+アナストロゾール1mg. 第一次目的は5年にわたるanastrozoleおよびtamoxifenのanastrozoleそして組合せ対tamoxifenの安全そして効力を評価することでした。 合計9,366人の患者-アナストロゾールの腕の3,125、タモキシフェンの腕の3,116、および組合せの腕の3,125–33か月の中央値のために扱われました。
三年後、アナストロゾールはタモキシフェンの89.4%対87.4%のDFSを示した(ハザード比0.83、95%CI、P=。013). アナストロゾールは、タモキシフェンと比較して対側乳がん(CLBC)の割合を減少させた(オッズ比0.42、95%CI、P=。007). 組合せの腕はtamoxifenを越える臨床利点が見つけられなかったので閉鎖しました。 Anastrozoleはendometrial癌(P=。02)、膣出血、放電(P<。0001)、脳血管イベント(P=。0006)、静脈血栓塞栓事象(P=.0006)、およびほてり(P<。タモキシフェンは、骨折の減少および関節痛の減少と関連していた(P<。0001). 68ヶ月後、アナストロゾールはDFSを増加させた(HR0.87、95%CI、P=。01)および再発までの時間(HR0.79,95%CI,P=.0005)および遠隔metastasesの減少(HR0.86、95%CI、P=。0 4)およびCLBC(4 2%減少、P=0.01).16 100ヶ月の中央値のフォローアップ間隔の後、アナストロゾールのHR+患者は、DFSの改善を示した(HR0.85;P=。003)、CLBCの発生(HR0.60,P=.004)、再発までの時間(HR0.76、P=。0001)、および遠隔再発までの時間(HR0.84、P=。022)タモキシフェンの患者と比較される。 再発率の絶対差は2から改善した。5年後の8%から9年後の4.8%。 アナストロゾール骨折率は治療中に高かったが、差は100ヶ月のフォローアップ期間後に大幅に減少した。 延長療法の期間にanastrozoleとの1.15対tamoxifenとの1.02のひびの危険がありました。 子宮内膜癌のリスクは、それぞれ0.043対0.14および0.014対0.12の年率で、タモキシフェンと比較して、アナストロゾール療法のオンとオフに減少した。 全生存率(OS)の差は同定されていない。
MA。1712,17:マ.17は既に5年間のアジュバントtamoxifen療法を完了していた乳癌を持つpostmenopausal女性のletrozole療法の5年間の有効性を査定する無作為化された、偽薬制御された、二重盲検 患者は5年間letrozole2.5mgか偽薬を毎日受け取りました。 プライマリエンドポイントはDFSで、セカンダリエンドポイントはquality of life、extended safety profile、およびOSでした。 5,187人の患者のうち、2,593人がレトロゾールを受け、2,594人がプラセボを受けた。
予備分析では、乳癌またはCLBCの初期悪性腫瘍の207の局所または転移性再発、レトロゾール群で75、プラセボ群で132があった。 両グループの予測された四年間のDFS率は、それぞれ93%と87%であった(P?.DFSの評価のための001)。 Letrozoleの腕では、DFSに0.61(95%CI、Pか。.001). Letrozoleは乳癌の発生の43%の減少を示しました(HR0.57、95%CI、P=。00008).4ノード陽性患者を除いて(P=。04)、OSは統計的有意性に達しなかった(HR0.82,P=.30).Letrozoleの腕の4人の患者は低悪性度のvasomotor徴候、筋肉痛および関節炎を経験しました。 Osteoporosisしょう症は偽薬対letrozoleの腕で(かなりが)共通でした(5.8%対4.5%;P=。07)、および骨折率は腕の間で同等であった。 調査はletrozoleの腕の乳癌のでき事の減少のために2.4年の中央値の後で閉鎖しました。 タモキシフェンの五年の完了の後のletrozoleの延長補助療法はDFSを改善しました。
BIG1-987,9,18:乳房国際グループ(BIG)1-98研究、二重盲検、多施設、無作為化試験は、HR+早期乳癌を有する閉経後女性8,028人を登録した。 この研究では、5年間のタモキシフェン単独療法、5年間のレトロゾール単独療法、2年間のタモキシフェン、3年間のレトロゾールへのスイッチ、または2年間のレトロゾール、3年間のタモキシフェンへのスイッチを評価した4つの治療アームが構成されていました。 主な目的はDFSでした; 副次的な目的は遠隔metastasisまでの時間,安全性,およびOSであった。 Dfsは、タモキシフェンを投与した患者と比較して、レトロゾールを投与した患者で増加した(HR0.81、95%CI、相対的な減少19%、P=。003)、三年で1.5%の絶対差を持つ。 タモキシフェンは、レトロゾール(または0.38、P<と比較して血栓塞栓イベントの発生を増加させた。0001). 骨折は、letrozole腕で増加した(または1.44、P=。006).
IES14,19: IES(グループ間エクセメスタン研究)は、その目的は、タモキシフェンの二から三年後にエクセメスタンへの変更が五年間タモキシフェンを継続するよりも効果的であったかどうかを決定することであった無作為化、二重盲検、多施設、第III相研究であった。 2,362人の被験者は、タモキシフェン20mg po qdの2〜3年後にエクセメスタン25mg po qdに切り替えて5年間の治療を完了する予定であり、残りの2,380人はタモキシフェン20mg po qdを5年間受ける予定であった。 DFSは主要なエンドポイントであり、二次エンドポイントはOS、拡張毒性プロファイル、およびCLBCの頻度であった。
30.6ヶ月の中央値にわたって発生した有害事象には、CLBC、局所または転移再発、および死亡の頻度が含まれてい 449のイベントがありました-エクセメスタン腕で183とタモキシフェン腕で266。 エクセメスタン群の未調整HRは0.68(95%CI,P<)であった。001ログランク試験による)、これはリスクの32%の減少を示し、4のDFSにおける利点に類似していた。75(95%CI)。 3年後、タモキシフェン群の86.8%(95%CI)と比較して、エクセメスタン群のDFSは91.5%(95%CI)であった。 両群の間にOSに有意差はなく、エクセメスタン群で93人が死亡し、タモキシフェン群で106人が死亡した。 CLBCの頻度に有意差があった(P=。04)–tamoxifenの腕の20の主題およびexemestaneの腕の9。 二から三年のtamoxifenの後で五年間の処置を完了するexemestaneの使用は五年間のtamoxifenと比較されるDFSを改善しました。
AI療法による骨損失の予防20
閉経後の女性は、エストロゲンのレベルが低下するため、BMDの低下を発症する傾向があります。 閉経後乳癌患者におけるA I療法はこの傾向を悪化させる。 デノスマブ、完全にヒトモノクローナル治験抗体は、核因子kBリガンド(RANKL)の受容体活性化剤に結合し、RANKL活性を防止します。 RANKLは骨の故障を意味する破骨細胞の活動のために重大です。 デノスマブとビスホスホネートであるリセドロネートは、AI療法に関連する骨損失を打ち消す能力について評価されています。
デノスマブStudy20:多施設、無作為化、第III相試験は、HR+非転移性乳がんのAIsを服用している閉経後の女性に6ヶ月に一度皮下投与されたデノスマブ60mgの使用を評価した。 目的は、ベースラインから12ヶ月までの腰椎BMDの変化を評価することでした。 252人の患者のうち、127人がデノスマブに割り当てられ、125人がプラセボに割り当てられた。 両腕にカルシウムとビタミンDを投与した。BMDは二重エネルギー x線吸収測定法により評価した。 デノスマブまたはプラセボによる12ヶ月および24ヶ月の治療後、デノスマブを支持する腰椎領域のBMD増加にそれぞれ5.5%および7.6%の差があった(P<
IBIS-IIボーンサブスタディ21: 国際乳がん介入研究-II(IBIS-II)骨サブ研究は、アナストロゾールまたはプラセボに無作為化された乳がんを発症する確率が高い閉経後の女性を評価したIBIS-II Substudyは、700人の患者の現在の登録と、ベースラインで低いTスコアの女性のBMDの損失の防止のための偽薬対risedronateを評価しています。 IBIS-II試験の患者のサブセットは、サブ試験で三つの異なる治療戦略のいずれかに割り当てられました。 治療の一年後、350アナストロゾールと350IBIS-IIからプラセボ患者はsubstudy結果を受けました。 層1は正常なTスコア(Tスコアか。1)、層2は骨減少症の80人の患者(φ2.5か。 T-score<1)週に一度リセドロネート35mgに割り当てられた患者、および層3は、骨粗鬆症患者43人(β4<T-score<2.5)週に一度リセドロネート35mgに割り当てられた患者であった。
ベースラインでosteopeniaまたは骨粗しょう症の患者のために、risedronateはanastrozoleと関連付けられる骨の損失を禁じるようで ストラタムIIでは、リセドロネートは、腰椎ではなく、全股関節のBMD保存に好ましい効果を示した(P=。005とP=.15対プラセボ)。 重篤な副作用または薬物相互作用は、リセドロネートと関連していなかった。
閉経前の女性(ソフト)21-26におけるAIsの試験
50歳未満の女性の約33%が浸潤性乳がんと診断されます。 22卵巣機能抑制試験(SOFT、IBCSG24-02、BIG2-02)は、HR+乳がんの閉経前女性におけるAI療法の使用を調査しています。 この試験では、3,000人の患者登録を目標としており、化学療法を完了したか、手術のみを受けたHR+乳がんの閉経前女性が対象となっています。 卵巣の切除はtriptorelin(性腺刺激ホルモン解放のホルモン)の管理、外科oophorectomy、または骨盤の照射によって5年間毎月一度確立されます。 患者は3つの腕のうちの1つに無作為化され、最初の腕は1日1回タモキシフェンを5年間、2番目の腕は5年間タモキシフェンを卵巣切除と組み合わせて、3番目の腕は5年間エクセメスタンを卵巣切除と組み合わせて受けています。 患者は5年間exemestaneかtamoxifenを受け取ります。
化学予防Trials23-27
タモキシフェンは乳がん化学予防のために示されています。6その毒性プロファイルは、治療上の使用に関する制約の原因である。AIsはATACのような臨床試験のTAMOXIFENと比較されるCLBCの発生の減少のために危険度が高い患者のHR+の乳癌の発生を減らすかもしれません。6
AI化学予防研究には、国際乳がん研究グループ(IBCSG)試験31-03(IBCSG31-03)とカナダ国立がん研究所のMAPが含まれます。3回目の裁判。 多施設、国際的な、無作為化された、偽薬制御されたIBCSG31-03試験の第一次目的はpostmenopausal女性の乳癌の防止のためのanastrozoleの使用を評価することです。 その第一次転帰の測定は侵略的で、非侵襲的な乳癌の発生です;二次転帰の測定は骨粗しょう症およびひびの発生です。5IBCSG31-03トライアルの目標登録数は6,000人です。 地図だ3試験は、閉経後の女性における化学予防剤としてエクセメスタンを評価します。 プラセボ対照マップの主な目的。3試験は侵略的な乳癌の発生の減少のexemestaneの有効性を査定することです。
潜在的な将来の用途:ケースレポート
Letrozoleは、多嚢胞性卵巣症候群を有する22人の女性における不妊治療を誘導するためにクロミフェン Letrozoleはクロミフェンによって引き起こされる周期の75%対周期の44.4%の排卵を引き起こしました。 四つの妊娠はレトロゾールによって誘発された排卵に起因し、有意な副作用はレトロゾールと関連していなかった。28,29
マッキューン-オルブライト症候群の患者は、思春期早期のためのアナストロゾールを与えられました;患者のエストラジオールは、アナストロゾールの2.5年後に正常化し、骨年齢は半年前までに進行しました。28,31増加したエストロゲンは、女性化乳房および性腺機能低下性性腺機能低下症を誘発する可能性がある。28,31AIの減少したエストロゲンは女性化乳房および性腺機能低下性性腺機能低下症の男性の正常な性腺刺激ホルモンそしてテストステロンで結 28,31,32
レトロゾールは、再発卵巣癌の患者で研究されました;レトロゾールを受けた患者は、疾患の安定化を有していた。28,33Neoadjuvant letrozoleはendometrial癌の10のpostmenopausal女性に与えられました; この薬剤は建設的な臨床的変化を示し、外科的影響はなかった。28,34
testolactone対anastrozoleによる処置が不妊の人で比較されたとき、二つの代理店の効力は類似していました。Klinefelterのシンドロームの28,35患者はanastrozoleとよりtestolactoneとの有効な処置がありました。28,35
結論
第三世代のAIsは、HR+乳がんの閉経後女性において優れたDFSを示しているが、これらの患者におけるAI療法の五年以上の臨床4全国外科アジュバント乳房および腸プロジェクト(NSABP)B-33(エクセメスタン)試験とMAのその後のランダム化。17(letrozole)試験は付加的な5年間偽薬対これらのAIsの使用を検査します。4AIsはタモキシフェンが禁忌とされるHR+postmenopausal女性のための適切な代わりです。4
第三世代AIsの有益な効果には、タモキシフェンと比較して、より許容毒性プロファイルと優れたDFSが含ま これらの代理店とtamoxifen間の効力のレベルは対等です。 治療の選択期間、長期毒性プロファイル、およびAIsの適切な投与シーケンスに関する不確実性が残っています。4つの新しい調査は必要AIsよりより少ない毒性を作り出す選択的なaromataseの変調器を作り出すためにです。25,36-37
1. ロバートソンJFR. Fulvestrant(FaslodexのⅡ)–よい薬剤をよりよくさせる方法。 腫瘍専門医 2007;12:774-784.
2. Ckオズボーン所属。 薬物療法:乳癌の処置のtamoxifen。 N Engl J Med. 1998;339:1609-1618.
3. 全国がん総合ネットワーク. 腫瘍学におけるNCCN臨床診療ガイドライン-v.1.2008. 乳がん。 www.nccn.org/professionals/physician_gls/f_guidelines.asp.アクセスOctober11,2007.
4。 Winer EP,Hudis C,Burstein HJ,et al. ホルモンの受容器肯定的な乳癌を持つpostmenopausal女性のためのアジュバント療法としてaromataseの抑制剤の使用の臨床腫瘍学の技術の査定のアメリカの社会:ステー Jクリン-オンコール 2005;23:619-629.
5. ダンBK、ウィッカーハムDL、フォードLG。 ホルモン関連の癌の防止:乳癌。 Jクリン-オンコール 2005;23:357-367.
6. Smith IE、Dowsett M.乳癌のAromataseの抑制剤。 N Engl J Med. 2003;348:2431-2442.
7。 Goss PE,Strasser K. 乳癌の処置そして防止のAromataseの抑制剤。 Jクリン-オンコール 2001;19:881-894.
8。 Lacy CF,Armstrong LL,Goldman MP,et al,eds. 医薬品情報ハンドブック. 第13回ed. 2005年:117,598,871.
9。 エリス-MJ,ed. 乳癌の処置のためのAromataseの抑制剤。 Manhasset,NY:Oncology Publishing Group,CMP Healthcare Media;2005:29-45.
10。 Arimidex(anastrozole)のパッケージ挿入物。 ウィルミントン,DE:AstraZeneca Pharmaceuticals LP;May2007.AstraZeneca Pharmaceuticals LP.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&show=dept&article_id=9884。 2008年3月17日に発売された。
14。 Aromasin(exemestane)のパッケージ挿入物。 ニューヨーク、ニューヨーク:ファイザー社、2007年2月。
15。 Atac TrialistsのグループのためのBaum M、Budzar AU、Cuzick J、et al。 単独でまたはtamoxifenを伴ってanastrozole対単独でtamoxifen早い乳癌を持つpostmenopausal女性のアジュバントの処置のための:ATACの無作為化された試験の最初結果。 ランセット 2002;359:2131-2139.
16。 Howell A,Cuzick J,Baum M,ET al,ATAC Trialists’Groupのために. 乳癌のための5年のアジュバント処置の完了の後のATAC(Arimidex、Tamoxifen、単独でまたは組合せで)試験の結果。 ランセット 2005;365:60-62.
17。 Goss PE,Ingle JN,Martino S,et al. 初期段階の乳癌のための5年間のtamoxifen療法の後のpostmenopausal女性のletrozoleの無作為化された試験。 N Engl J Med. 2003;349:1793-1802.
18。 Thrlimann B,Keshaviah A,Coates AS,et al,For The Breast International Group(BIG)1-98Collaborative Group. 早い乳癌を持つpostmenopausal女性のletrozoleそしてtamoxifenの比較。 N Engl J Med. 2005;353:2747-2757.
19。 グループ間エクセメスタン研究のためのCoombes RC、Hall E、Gibson LJ、et al。 原発性乳癌を有する閉経後の女性におけるタモキシフェン療法の二から三年後のエクセメスタンのランダム化試験。 N Engl J Med. 2004;350:
1081-1092.
20。 Ellis G,Bone HG,Chlebowski R,et al. 非転移性乳癌に対するアロマターゼ阻害剤を投与されている女性の骨密度に対するデノスマブ療法の効果に関する第3相試験。 で発表された論文:第30回サンアントニオ乳がんシンポジウム;December13-16,2007;サンアントニオ,テキサス州. アブストラクト47.
21。 Singh S,Cuzick J,Edwards R,et al. 処置の1年後の骨のミネラル密度に対するanastrozoleの効果:国際的な乳癌の介在の調査(IBIS-II)の骨の副調査からの結果。 で発表された論文: 30Th Annual San Antonio Breast Cancer Symposium;December13-16,2007;San Antonio,TX. アブストラクト28.
22。 Dellapasqua S、Colleoni M、Gelber RD、Goldhirsch a.早い乳癌を持つpremenopausal女性のための補助的な内分泌療法。 Jクリン-オンコール 2005;23:1736-1750.
23。 国立がん研究所。 乳がん治療(PDQ)。 www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional.アクセスDecember26,2007.
24。 医学の臨床試験のベイラー大学。 卵巣機能の抑制試験(ソフト)。 www.breastcenter.tmc.edu/clinic/trials/soft.htm.アクセスDecember26,2007.
25。 Aebi S、Castiglione-Gertsch M.非常に若い患者のためのアジュバント内分泌療法。 胸。 2003;12:509-515.
26。 ClinicalTrials.gov。ホルモン敏感な乳癌とpremenopausal女性の処理で単独でtamoxifenと比較されるtamoxifenかexemestaneと卵巣機能の抑制。 www.clinicaltrials.gov2007年12月26日に発売された。
27。 クジック・J. 乳癌の防止のためのAromataseの抑制剤。 Jクリン-オンコール 2005;23:1636-1643.
28。 Karaer O,OruÁ S,Koyuncu FM. Aromataseの抑制剤:可能な未来の適用。 アクタ産科婦人科 2004:83:699-706.
29。 Mitwally MF,キャスパー RF. Clomipheneのクエン酸塩への不十分な応答の患者の排卵の誘導のためのaromataseの抑制剤の使用。 フェチルステリル… 2001;75:305-309.
30。 Bulun SE,Yang S,Fang Z,et al. 子宮内膜疾患におけるアロマターゼの役割。 Jステロイドバイオケムモールバイオール… 2001;79:19-25.
31。 Feuillan P,Merke D,Leschek EW,Cutler GB. 早熟な思春期のaromataseの抑制剤の使用。 EndocrのRelat癌。 1999;6:303-306.
32。 Shozu M,Sebastian S,Takayama K,et al. Aromataseの遺伝子に影響を与える新しい利益の機能突然変異と関連付けられるエストロゲンの余分。 N Engl J Med. 2003;348:1855-1865.
33。 Bowman A,Gabra H,Langdon SP,et al. CA125の応答は卵巣癌のletrozoleの段階IIの試験のエストロゲンの受容器の表現と関連付けられます: 内分泌感受性サブグループの同定。 Clin Cancer Res.2002;8:2233-2239。
34。 Berstein L,Maximov S,Gershfeld E,et al. Aromataseの抑制剤のletrozoleとのendometrial癌のNeoadjuvant療法:内分泌および臨床効果。 ユール-ジュリエット-ジュリエット-ジュリエット-ジュリエット-ジュリエット 2002;105:161-165.
35。 ラマンJD、シュレーゲルPN。 男性の不妊のためのAromataseの抑制剤。 J-ウロール 2002;167:624-629.
36。 Simpson ER、Dowsett M.Aromataseおよび抑制剤:乳癌療法のための重大さ。 最近のProg Horm Res.2002;57:317-338.