細胞の酸化還元電位は何ですか?
リーダーモード
酸化還元電位は、電子移動を含む反応の自由エネルギーコストと方向を特徴付けるために使用され、最もユビキタスで重要な生化学反応の一つである。 このような還元-酸化反応は、電子移動ではなくプロトン移動が関与する酸-塩基反応におけるpKaを記述するために使用されるものといくつかの概念的な特徴を共有する自由エネルギー変化によって特徴付けられる。 このビネットでは、本の中で最も抽象的なの一つは、我々は、酸化還元電位が目的の所与の酸化還元反応の駆動力の尺度として使用することができる方 対照的に、pHとは異なり、細胞全体に単一の酸化還元電位を割り当てることができる意味はない。化合物の酸化還元電位、より正確には還元電位は、電子を獲得し、それによって還元される傾向を指す。
化合物の酸化還元電位、より正確には還元電位は、電子を獲得し、それによって還元される傾向を指す。
一部の読者は、「酸化は損失であり、還元は利益である」ということを思い出させるニーモニック「OILRIG」を覚えているかもしれません。 電子移動を伴う反応を考えてみましょう:Aox+ne–π Aredここで、n個の電子が酸化形態(Aox)によって取り込まれ、化合物Aの還元形態(Ared)が得られる。 電子供与体と受容体の間の酸化還元電位差Δ Eは、Δ G=nf δ eを介した反応の関連する自由エネルギー変化Δ Gに関連しており、nは移動する電子の数であり、Fはファラデー定数(96,485J/mol/Vまたは≤100kJ/mol/V)である。 これらの電位の表計算された値を調べることによって、電子移動の傾向、したがって反応の方向に対する直感を開発することが可能である。

図1:一般的な代謝ハーフ反応の酸化還元電位を示す”酸化還元塔”。 代謝プロセスは、多くの場合、解糖や呼吸のように、電子が高エネルギーから低エネルギー状態に移動するように放出されたエネルギーの一部を捕獲し、分子間で電子を移動させると見ることができます。 上部の”半反応”によって寄付された電子は、熱力学的に有利な反応を完了するために、塔の下部の半反応で消費することができます。 例えば、解糖の正味のプロセスは、グルコースのピルビン酸への酸化を含み、NAD+のNADHへの還元に結合する。 グルコースの酸化は塔の上部にあり、NAD+の還元はその下にあるので、この電子流は熱力学的に有利である。 ATP加水分解スケールバーと比較すると、この電子流がATPを生成するのに十分有利であることもわかります。 好気性呼吸には、電子輸送鎖を介した多くの中間電子移動が含まれる。 これらの遷移のいくつかは、機械的に内部mitochrondrial膜におけるユビキノンのユビキノールへの還元に結合されているフマル酸塩への酸化コハク酸を含む、示されている。 これらの中間電子移動のそれぞれは、呼吸が進行するためには、それ自体が熱力学的に有利でなければならない。 「ATP加水分解スケール」と比較することにより、電子輸送鎖における個々の変換は、ATPを単独で生成するのに十分なエネルギーではないことがわかります。 けれどもそれらは細胞かmitochondrial膜を渡るプロトンをポンプでくむには十分に好ましいです。 これはchemiosmosisのための精力的な基礎である:細胞は膜を渡るプロトンの勾配のATPの統合のために余りに小さいエネルギーの量子を貯える。 このエネルギーは後に、ATP合成酵素を介してH+勾配をatp上のリン酸無水物結合に変換することによってATPを生成するために使用される。
ATPはしばしば細胞のエネルギー通貨であると主張されていますが、実際には、細胞のエネルギーバランスのために、電力を減少させるキャリ これらの担体の最も重要な例は、還元または酸化された(NAD+)形態の分子NADHである。 酸化還元電位を使用してこれら2つの分子主役を接続し、NADHの酸化から生成され得るATP分子の数の上限を推定することができます(例えば、TCAサイク NAD+/NADHの対はE=-0.32Vの酸化還元電位を持ち、酸素によって酸化され、e=+0.82Vの酸化還元電位を持つ水(媒体から来る陽子)を与える。 酸素によるNADH酸化の上で考慮される反応のために、抽出することができる最大の関連自由エネルギーは、したがって、
Δ G=n×f×Δ E=2×100kJ/(molxV)x(0.82-(-0.32))V=230kJ/mol≥90kBTであり、
ここで、n=2およびF≤100kJ/mol/Vである。ATP加水分解は、生理学的条件下で≤50kJ/molの自由エネルギー変化を有するので、ATP加水分解は、生理学的条件下で≤50kJ/molの自由エネルギー変化を有する。条件我々は、228KJ/molが228/50÷4.5atpsの最大値を生成するのに十分であることがわかります。 細胞では、NADHの酸化は呼吸の複数のステップによって進み、電気化学ポテンシャル(BNID101773)に対して膜を渡る10のプロトンの移動で起因します。 これらのプロトン移動は、生化学的エネルギーを捕捉するさらに別の方法に対応する。 このエネルギーはATPaseによって2-3Atpを作り出すのにそれから使用されています。 したがって、NADHから酸素への電子の移動で放出されたエネルギーの約半分がATPで保存されていることがわかります。 ATPを消費するのではなく、atpを生成するために反応が方向的に進行することを確実にするには、システムが平衡から外れなければならないので、エネルなぜ半反応の酸化還元電位を議論すべきであり、完全反応の自由エネルギーではないのですか?
なぜ完全反応の自由エネルギーではないのですか?
単位自体は実験室で電圧相違、すなわちボルトで測定される潜在性を、異なった電子キャリアを含んでいる2つの部屋を渡って測定し、電圧との純反 半反応のための酸化還元電位の有用性は、熱力学的実現可能性とすべての考慮された反応のエネルギー利得を評価するために、異なるドナーとアクセプタの組み合わせを組み立てる能力にある。 K個の可能な電子移動化合物がある場合、k個の酸化還元電位のみに基づいて~k2個の可能な反応を予測することができます。
溶液のpHについて話すのと同じように、最初の推測では、細胞の明らかに類似した酸化還元電位について話すことが可能であると想像するかもしれません。
与えられた反応対の還元および酸化形態の濃度を知ることは、関係を介してそれらのプール酸化還元電位を定義する
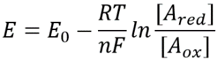
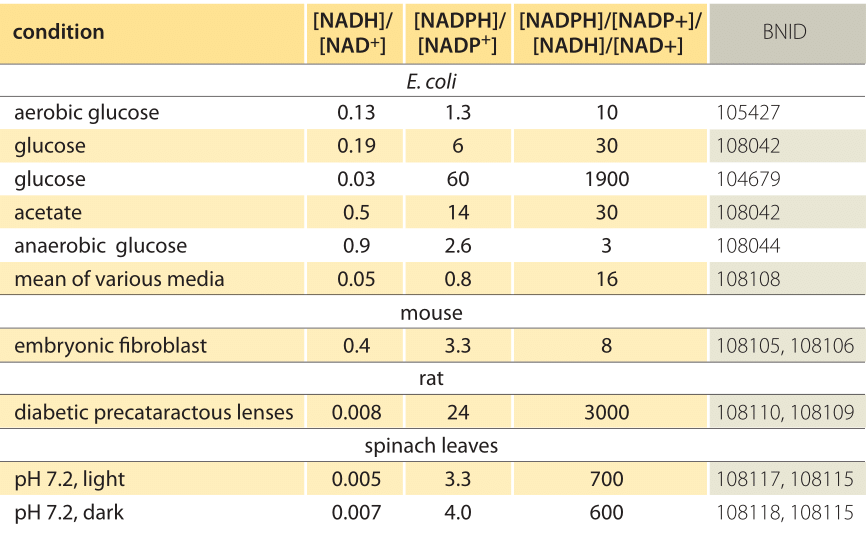
表1:共通の電子ドナー対NAD/NADHおよびNADP/NADPHの濃度比。 見ることができるように、第一は比較的酸化され、第二は比較的それらの間の比率で比較的減少し、通常は1よりもはるかに大きい。この方程式(いわゆるネルンスト方程式)は、標準状態条件(定義上=)とは対照的に、細胞に典型的な濃度条件の下での酸化還元電位の値を提供する。
一例として、酸化された形態のNADHをもたらすnad+への電子の供与を考えてみましょう。 ミトコンドリアマトリックスでは、表1に示すように、酸化形態の10倍以上の比率が報告されている(BNID100779)。 この場合、因子は≦30mVであり、したがって酸化還元電位は-0.32Vから-0.29Vに変化することがわかります。 我々が得た効果の方向が賢明であることを確認するために、酸化形態が過剰であると、酸化還元電位が酸素/水電子交換対(+0.82V)のそれに以前よりも近
細胞は平衡状態ではなく、異なる酸化還元対の間に弱い結合がある。
細胞は平衡状態ではなく、異なる酸化還元対の間に弱い結合 この状況は、細胞内に共存する酸化還元対のための異なる酸化還元電位の確立につながる。 酸化還元対の還元および酸化形態の生産および利用のフラックス、AredおよびAoxおよび別のBreedおよびBoxが、それらの相互変換フラックス、Ared+Box<>Aox+Breedよりもはるかに大きい場合、AおよびBは非常に異なる酸化還元電位を持つことができる。 その結果、細胞内の異なる成分に対して異なるため、細胞の全体的な酸化還元電位について尋ねることは不適切に定義されています。 対照的に、水は異なる酸-塩基反応を結合し、すべての種の化学ポテンシャルとして知られているものを平衡化する普遍的な媒体として機能するので、細胞のpH(またはその中のいくつかのコンパートメントのpH)ははるかによく定義されている。
与えられた細胞区画内の与えられた酸化還元対について、二つの形態の濃度比は明確に定義された方法で酸化還元電位を規定する。
与えられた 電子を迅速に交換する化合物は相対平衡にあり、したがって同様の酸化還元電位を共有する。 これらのアイデアがどのように発揮されるかを見るためには、多くの重要な細胞反応に関与し、その結果、多くの化合物の酸化還元状態に密接に関連している酸化還元対を考慮することが最も有用である。 細胞質のグルタチオンは多くの蛋白質のシステインのアミノ酸の非常に流行したチオールの結束(硫黄を含んでいるそれら)の減少そして酸化に加 グルタチオンはトリペプチド(3つのアミノ酸で構成される)であり、中心のものは還元型(GSH)または酸化型であり、別のグルタチオン分子(gssgと表記される)からシステインと二量体を形成するシステインである。 したがって、グルタチオンの半反応は2x GSH<>GSSG+2e–+2H+である。 他の半分の反作用は頻繁にこうしてグルタチオンの一定した行為のために減らされた形態で保たれる受容蛋白質で”開かれる”硫黄の結束です。 グルタチオンはまた電子を強奪し、こうして他の分子を酸化する高い傾向がある反応混合物の中和の支配的なプレーヤーです。 このような化合物は、例えば、呼吸または光合成の電子移動反応の能力に達したときのように酸化ストレス下で作られる。 総称してROS(活性酸素種)と呼ばれ、細胞内に大混乱を引き起こす可能性があり、老化の多くのプロセスに関与しています。 タンパク質を適切に折り畳まれた状態に保ち、ROSを制限する上でのグルタチオンの二重の役割、ならびにその比較的高い濃度および電子移動反応性は、それを細胞の酸化還元状態のための主要なプロキシとする。 細胞のグルタチオンの集中は≥10mm(bnid104679、104704、111464)であり、それを細胞の二番目に豊富な代謝物質にします(グルタミン酸塩の後で)蛋白質機能の酸化還元制御の電子供与体として支配的な役割を担うことを保障します。 細胞の他の機能には、他の支配的な電子対がある。 生合成同化反応ではNADP+/NADPHペアと分解異化反応ではNAD+/NADHです。
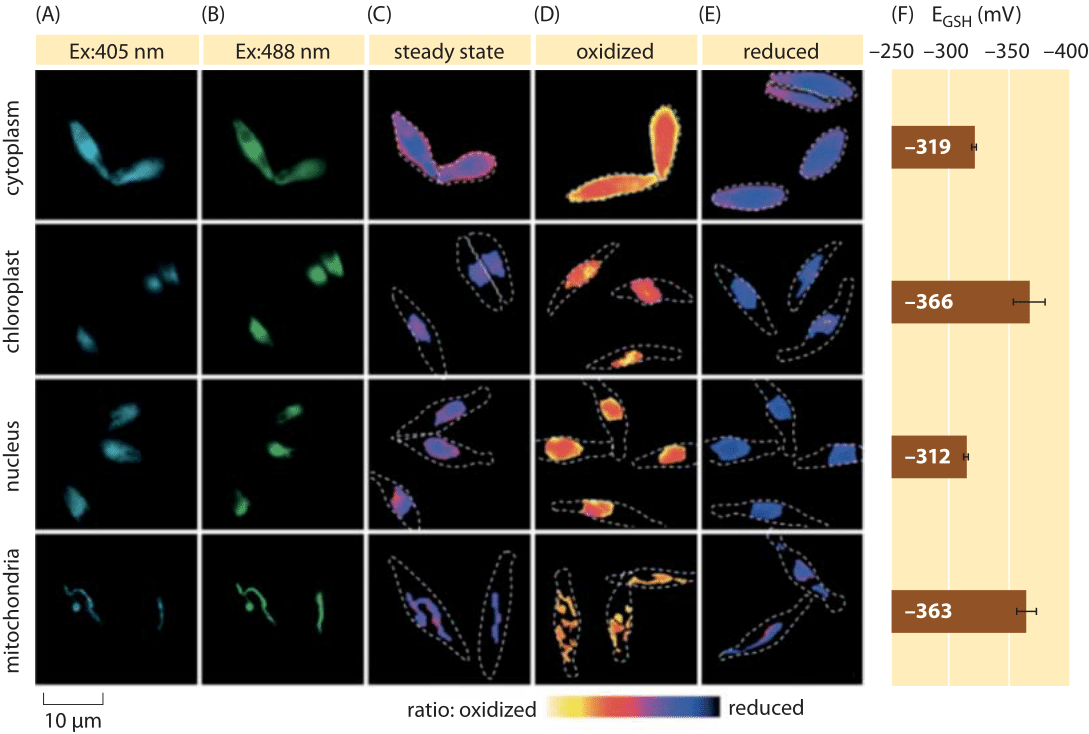
図2:生体内の珪藻藻類におけるグルタチオンプールの細胞内酸化還元電位のイメージング。 様々な細胞内局在におけるrogfp2を発現するp.tricornutum細胞の蛍光顕微鏡イメージング。 二つの励起波長(A,B)における蛍光画像を分割してレシオメトリック値(C)を得た。 口径測定のために、ratiometricイメージは強い酸化剤(150のmM H2O2)(D)およびreductant(1つのmM DTT)(E)条件の下で捕獲される。 破線は、明視野画像に基づいて描かれたセルの輪郭を表します。 (F)グルタチオンプールの定常状態酸化還元電位、mV中のEGSHは、各オルガネラの与えられたpH値の下での酸化レベルを使用してNernst式に基づいて計算された。 から適応:S.Graff van Creveld et al. ら,2 0 1 5.生きている細胞の酸化還元電位を測定するにはどうすればよいですか?
蛍光タンパク質革命のさらに別の受益者は、酸化還元電位の対象でした。 レポーター GFPはグルタチオンのプールによる減少に基づいて蛍光性に影響を与えるシステインのアミノ酸の結合によって酸化還元敏感であるために設計された。 図2は、このようなレポーターを使用して珪藻の異なる区画におけるグルタチオン酸化還元電位を調べた結果を示しています。
異なる細胞小器官におけるグルタチオンプールの酸化還元状態の測定から、様々な条件下で、還元型から酸化型の濃度の比を推測することができる。 値は、ERおよびアポトーシス細胞において約−1 7 0mVから、他のほとんどの細胞小器官および増殖細胞において約−3 0 0mVまでの範囲である(BNID1 0 3 5 4 3、1 0 1 8 2 3、1 1 1 4 5 6、1 1 1 4 6 5)。 グルタチオンの標準的な酸化還元電位が-240mV(BNID111453、111463)であることを考えると、還元と酸化グルタチオンの比率は何ですか? ネルンスト方程式(またはボルツマン分布から)を用いて、生成物/反応物比の十倍の変化は、自由エネルギー(≧6kj/mol)の増加に対応する(≧2kBT)。 GSH/GSSG反応で移動する2つの電子を考えると、この濃度比の変化は通常30mvに等しいが、グルタチオンの場合、2つのGSH分子が一つのgssg共有結合分子に合流する化学量論はこれを近似に過ぎない。 条件全体で報告された100mVの変化は、約等量の還元型と酸化型(アポトーシス細胞における)との間の濃度の比を、還元型の1,000倍以上の濃度に反映する。 実際にほとんどの細胞条件で酸化させた形態は生理学的な含意の全面的なプールしかしまだの非常に小さい一部分だけである。
酸化還元反応の一つの混乱の側面は、転送がいくつかの形を取ることができるということです。 一つのケースでは、電子移動鎖中のシトクロムによって行われる反応のように電子のみである。 別の一般的なケースでは、補因子NAD+/NADHのように電子と陽子の組み合わせであり、2つの電子と1つの陽子(H+)が移動します。 最後に、水素の移動を議論したいと自然に誘惑されるときに、同じ数の電子と陽子が移動する反応があります。 これは、例えば、酸素が水に還元されるグルコース酸化の全体的な反応の場合である。 したがって、2つの水素が移動されているので、電子、水素、または陽子の移動について議論する必要がありますか? 酸化還元電位の定義(上記)は、電子の”状態”にのみ焦点を当てています。 いくつかの中間化合物が水素陽子を含み、いくつかが含まれない電子移動反応の連鎖に遭遇したときに、陽子についてはどうなりますか? 説明は周囲の水およびpHに存在します。反作用はある特定のpHで起こり、反応の混合物はこのpHと平衡にあり、こうしてプロトンを与えるか、または受 水性媒体は、移動反応が電子のみである場合に陽子を「駐車」することができるプールとして機能する(Steven Roseの非常にアクセス可能な入門生化学の本「The chemistry of life」から借用された類推)。 これらのプロトンは、シトクロムオキシダーゼが媒体からプロトンを取る酸化呼吸の最終段階で起こるように、その後の段階で借用することができる。 水が遍在していると仮定しているので、陽子を与えるか受け取る傾向を示す一般的なpHを知ることを除いて、陽子を説明する必要はありません。 This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




