非局在化とは何ですか?非局在化は、電荷が複数の原子に広がっているときに起こります。
非局在化は、電荷が複数の原子に広がっているときに起こります。 例えば、結合電子は、一緒に結合しているいくつかの原子の間に分布していてもよい。

例1:
結合電子が非局在化されている分子の最もよく知られている例の一つは、以下に示すベンゼンである: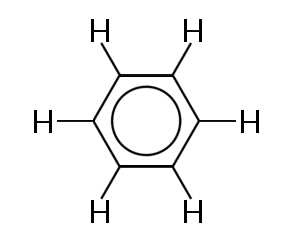
結合電子が非局在化されている分子の最もよく知られている例の一つは、以下に示すベンゼンである:

ベンゼンは六つの炭素原子の環で構成されている。 炭素原子は全てsp2であり、一つの非架橋p軌道とハイブリダイズされている。
sp2ハイブリッド軌道は通常の共有結合を生成し、σ結合と呼ばれることもあります:これらは単一のC-C結合と単一のC-H結合です。
これにより、各炭素は環の平面に対して直角にp軌道内の電子を残す。
これにより、各炭素は環の平面に対して直角に電子を残す。
下の図では、左に共有結合を形成するsp2軌道が見えます。 右側には、それぞれに電子が含まれているp軌道が見えます。
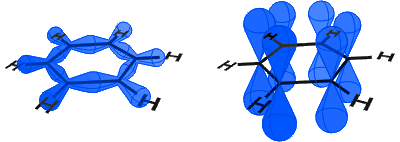
p軌道は側に結合し、p軌道の電子はπ電子として記述されます。下の図では、p軌道が結合し、π電子が非局在化されています。
平均して、すべての環結合は同一である。
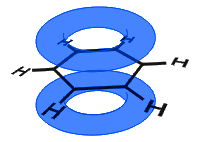
以下の次の例とは異なり、ベンゼン中の非局在化電子は分子内に保持され、バルク材料を自由に移動することはできません。
例2:
金属は、原子中の最も外側の電子が非局在化しているため、高い熱伝導率と電気伝導率を持っています。 これらの電子は、任意の特定の金属核に関連付けられていないので、金属全体を自由に移動することができます。
謝辞:ベンゼンの軌道の青い色の画像はSansculotteの礼儀です。 これらの画像は、クリエイティブ*コモンズ表示-共有類似1.0汎用ライセンスの下でライセンスされています。