学習目標
- セル表記を使用してガルバニック細胞を記述する
- ガルバニック細胞の基本的な構成要素を記述する\
ガルバニ 式を書く際には、全体的な式のバランスを容易にし、実際の化学変換を強調するために、酸化還元反応を半反応に分離することがしばしば便利である。きれいな銅の金属片が硝酸銀の溶液に置かれたときに何が起こるかを考えてみましょう(図\(\PageIndex{1}\))。 銅金属が添加されるとすぐに、銀金属が形成され始め、銅イオンが溶液中に通過する。 右端の溶液の青色は、銅イオンの存在を示しています。 反応は、その二つの半反応に分割することができます。 半反応は酸化と還元を分離するので、それぞれを個別に考慮することができる。還元半反応の式は2倍にしなければならなかったので、還元半反応で「得られた」電子の数は酸化半反応で「失われた」電子の数に相当しました。
還元半反応の式は、還元半反応で「得られた」電子の数が酸化半反応で「失われた」電子の数に等しくなりました。p>

ガルバニックまたは電圧セルは、電流が外部ワイヤを流れることができるように、半反応が分離された自発的な電気化学反応を伴う(図\(\PageIndex{2}\))。 図の左側のビーカーはハーフセルと呼ばれ、1Mの硝酸銅(II)溶液を含み、銅金属の一部が溶液中に部分的に浸漬されている。 銅金属は電極である。 銅は酸化を経ています;従って、銅の電極は陽極です。 陽極はワイヤーによって電圧計に接続され、電圧計の他のターミナルはワイヤーによって銀製の電極に接続されます。 銀は還元を受けているので、銀電極は陰極である。 図の右側のハーフセルは、硝酸銀(Agno3)の1M溶液中の銀電極で構成されています。 この時点では、電流は流れず、回路が開いているためにワイヤを通る電子の大きな動きは発生しません。 回路は、移動するイオンで電流を伝達するソルトブリッジを使用して閉じられています。 塩架橋は、この実施例で使用される硝酸ナトリウム(Nano3)溶液のような、濃縮された非反応性の電解質溶液からなる。 電子が電極およびワイヤーを通って左から右に流れると同時に、硝酸イオン(陰イオン)は銅(II)の硝酸塩の解決に左の多孔性のプラグを通ります。 これは、銅金属が酸化されるときに溶液中で生成される銅(II)イオンの電荷を中和することによって、ビーカーを電気的に中性に保つ。 同時に、硝酸イオンは左に移動し、ナトリウムイオン(陽イオン)は右に移動し、多孔質プラグを通って、右の硝酸銀溶液に移動する。 これらの添加された陽イオンは、溶液から除去された銀イオンを銀金属に還元して”置換”し、ビーカーを電気的に中性に保つ。 ソルトブリッジがなければ、コンパートメントは電気的に中性のままではなく、大きな電流は流れません。 ただし、2つの区画が直接接触している場合は、塩橋は必要ありません。 回路が完了した瞬間に、電圧計は+0.46Vを読み取り、これはセル電位と呼ばれます。 セル電位は、二つの異なる金属が接続されているときに作成され、酸化還元反応から利用可能な単位電荷あたりのエネルギーの尺度です。 この式では、aは電流(アンペア単位)、Cは電荷(クーロン単位)です。 ジュール(J)のエネルギーを得るためには、ボルトにクーロン(c)の電荷を掛けなければならないことに注意してください。
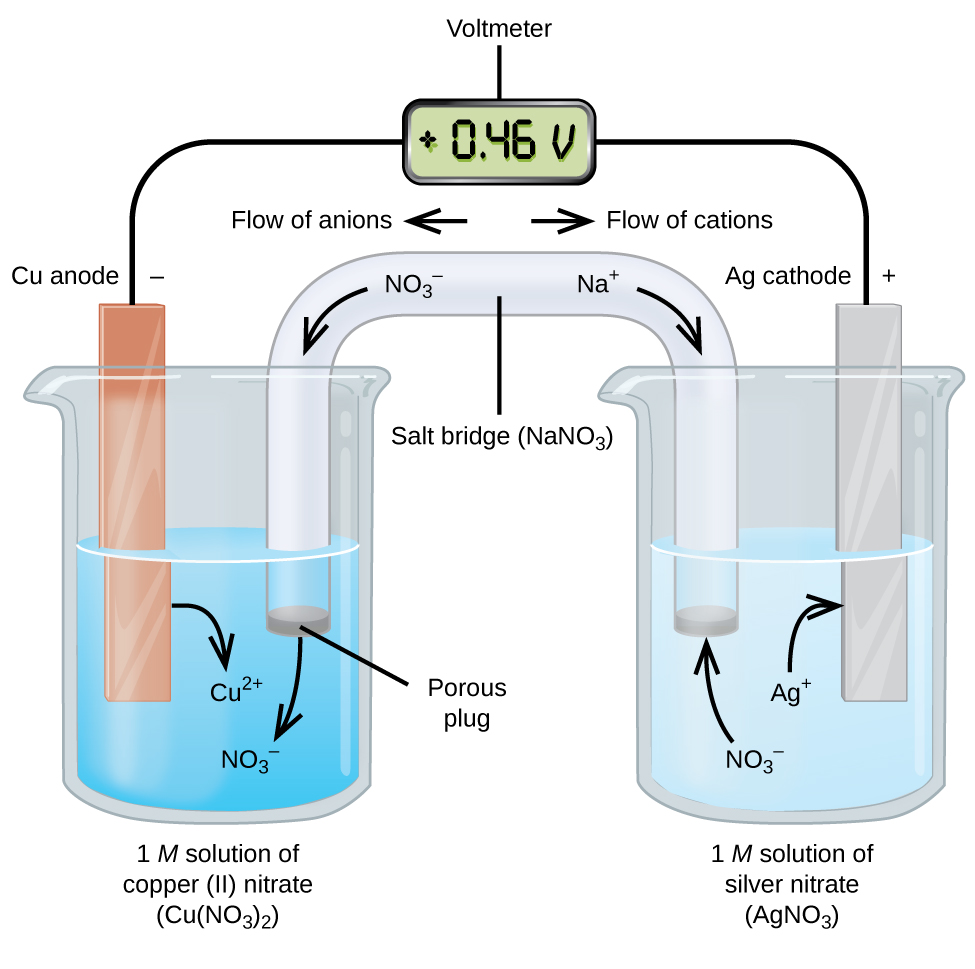
電気化学セルがこのように構築されている場合、正のセル電位は自発反応を示し、電子が左から右に流れていることを示します。 図\(\PageIndex{2}\)にはたくさんのことが起こっているので、このシステムのことを要約すると便利です:
- 電子は陽極から陰極に流れます:図の標準的なガルバニックセルでは左から右に。
- ここでは酸化が起こるため、左半電池の電極が陽極です。 この名前は、塩の橋の陰イオンがそれに向かって流れていることを指しています。
- ここでは還元が行われるため、右半電池の電極が陰極になります。 この名前は、塩の橋の中の陽イオンの流れを指しています。
- 酸化は陽極(図の左のハーフセル)で発生します。
- 還元はカソード(図の右半分のセル)で起こります。
- セル電位+0.46Vは、この場合、二つのハーフセルを作るために使用される材料の性質の固有の違いに起因する。
- 回路を閉じる(完了する)ためには塩ブリッジが存在しなければならず、電流が流れるためには酸化と還元の両方が発生しなければならない。多くの可能なガルバニックセルがあるため、通常はそれらを記述するために速記表記が使用されます。 細胞表記法(細胞図と呼ばれることもある)は、反応に関与する様々な種に関する情報を提供する。 この表記法は、他のタイプのセルに対しても機能します。 垂直線μは相境界を示し、二重線μは塩橋を示す。 アノードに関する情報は左に書き込まれ、続いてアノード溶液、ソルトブリッジ(存在する場合)、カソード溶液、そして最後にカソードに関する情報が右に書き込まれ 図\(\PageIndex{2}\)のガルバニックセルのセル表記は、
\
スペクテーターイオンは含まれておらず、各半反応の最も単純な形式が使用されたことに注意してください。 既知の場合、種々のイオンの初期濃度が通常含まれる。
最も単純な細胞の一つは、ダニエルセルです。 この電池は、瓶の底に銅電極を置き、金属を硫酸銅溶液で覆うことによって構築することが可能である。 硫酸亜鉛溶液を硫酸銅溶液の上に浮かべ、次いで硫酸亜鉛溶液中に亜鉛電極を置く。 銅電極を亜鉛電極に接続すると、電流が流れることができます。 これは塩橋のないセルの例であり、イオンは2つの溶液間の界面を横切って流れる可能性があります。いくつかの酸化還元反応は、電気の貧弱な導体である種を含むので、反応に関与しない電極が使用される。
多くの場合、電極は白金、金、またはグラファイトであり、それらはすべて多くの化学反応に対して不活性である。 そのようなシステムの1つが図\(\PageIndex{3}\)に示されています。 図の左の陽極ではマグネシウムが酸化され、右の陰極では水素イオンが還元されます。 反応は次のように要約することができます
\セルは陰極に不活性な白金線を使用していたので、セル表記は
\マグネシウム電極は酸化還元反応に関与するため活性電極である。 不活性電極は、図\(\PageIndex{3}\)の白金電極のように、酸化還元反応に関与せず、電流がセルを流れることができるように存在する。 白金または金は、化学的に不活性であるため、一般的に良好な不活性電極を作る。
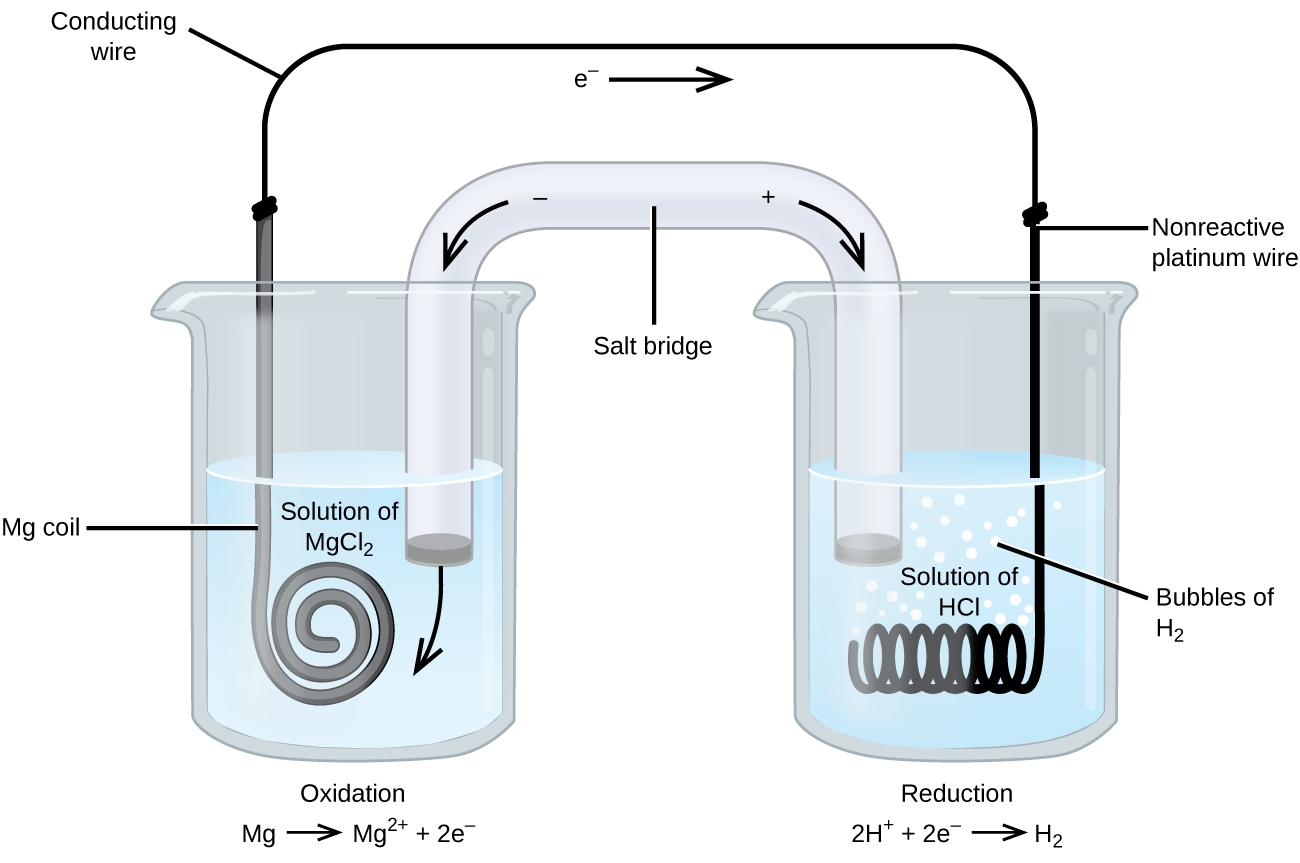
図\(\PageIndex{2}\):マグネシウムイオンへのマグネシウムの酸化は、この装置の左側のビーカーで発生します。 非反応性、または不活性な白金線は、左ビーカーからの電子が右ビーカーに移動することを可能にする。 全体的な反応は、\(\ce{Mg+2H+√Mg^2++H2}\)であり、これはセル表記では\(\ce{Mg}(s)√\ce{Mg^2+}(aq)√\ce{H+}(aq)√\ce{H2}(g)√\ce{Pt}(s)\)で表されます。Figcaption> 例\(\PageIndex{1}\):セル表記を使用して
で構成されるガルバニックセルを考えてみましょう
\
酸化と還元の半反応を書き、セル表記を使用して反応を書きます。 どの反応が陽極で起こるのですか? カソード?
溶液
検査により、3つの電子が失われてCr3+を形成し、Cu2+が2つの電子を獲得してCuを形成するにつれて還元されると、Crは酸化されます。
溶液
検査により、Crは酸化されます。 電荷のバランスをとると、
\
セル表記は、それぞれの方程式の最も単純な形式を使用し、陽極での反応から始まります。 濃度は指定されていないので、
\
酸化は陽極で起こり、陰極で還元される。例\(\PageIndex{2}\):セル表記を使用して
で構成されるガルバニックセルを考えてみましょう
\酸化と還元の半反応を書き、セル表記を使用して反応を書きます。 どの反応が陽極で起こるのですか? カソード?
溶液
検査により、Fe2+は1電子が失われてFe3+を形成すると酸化を受け、Mno4−は5電子を獲得してMn2+を形成すると還元されます。
溶液
検査により、Fe2+は1電子が失われてfe3+を形成すると酸化を受けます。 電荷のバランスをとると、
\
セル表記は、それぞれの方程式の最も単純な形式を使用し、陽極での反応から始まります。 陽極から陰極に電子を伝導させるために金属が存在しないため、白金などの不活性電極を使用する必要があります。 濃度は指定されていないので、
\
酸化は陽極で起こり、陰極で還元される。セル表記を使用して、銅(II)イオンが銅金属に還元され、亜鉛金属が亜鉛イオンに酸化されるガルバニックセルを記述します。
運動\(\PageIndex{1}\)
セル表記を使用して、銅(II)イオンが銅金属に還元され、亜鉛金属が亜鉛イオンに酸化されるガルバニックセルを記述します。
答え
問題で与えられた情報から:
\
セル表記を使用して:
\
要約
電気化学セルは、通常、二つの半セルで構成されています。 ハーフセルは、酸化半反応を還元半反応から分離し、電流が外部ワイヤを流れることを可能にする。 図の左側に通常描かれている半分のセルには、陽極が含まれています。 酸化は陽極で起こる。 陽極は、多くの場合、図の右側に示されている、他のハーフセルの陰極に接続されています。 還元は陰極で起こる。 ソルトブリッジを追加すると、電流を流すことができる回路が完成します。 塩架橋中の陰イオンは陽極に向かって流れ,塩架橋中の陽イオンは陰極に向かって流れた。 これらのイオンの動きは回路を完了し、各ハーフセルを電気的に中性に保つ。 電気化学セルは、セル表記を使用して記述することができる。 この表記では、陽極での反応に関する情報が左側に表示され、陰極での反応に関する情報が右側に表示されます。 ソルトブリッジは二重線πで表されます。 半セル内の固体相、液体相、または水相は、単線γによって分離される。 様々な種の相と濃度は、種名の後に含まれています。 酸化還元反応に関与する電極は活性電極と呼ばれる。 酸化還元反応には関与しないが、電流を流すために存在する電極は不活性電極である。 不活性電極は、多くの場合、多くの化学反応によって変化しない白金または金から作られる。
用語集
電気化学セルの酸化還元反応に関与する活性電極;酸化還元反応中に活性電極の質量が変化する酸化が起こる電気化学セル; セル表記法セル表記法電気化学セルにおける反応を表すための速記の方法異種金属が接続されているときに生じる電位のセル電位差; 酸化還元反応における電荷(電流)の流れのための駆動力ガルバニックセル自発的な酸化還元反応を伴う電気化学セル;正のセル電位を有する電気化学セル;また、電流が流れることができますが、それ以外の場合は電気化学セルにおける酸化還元反応に関与していないボルタセル不活性電極電極と呼ばれる;不活性電極の質量は、酸化還元反応中に変化しません。; 不活性電極は、これらの金属が化学的に不活性であるため、しばしば白金または金で作られる。 voltaic cellガルバニックセルの別の名前
貢献者と帰属
-
Paul Flowers(ノースカロライナ大学-ペンブローク大学)、Klaus Theopold(デラウェア大学)、Richard Langley(Stephen F.Austin州立大学)。 OpenStax Collegeが作成した教科書コンテンツは、Creative Commons Attribution License4.0ライセンスの下でライセンスされています。 で無料でダウンロードhttp://cnx.org/contents/85abf193-2bd…[email protected])。
div
-