このアルキルハロゲン化物があり、ナトリウムエトキシドのような強塩基で処理されたときにE2反応のすべての生成物を決定する必要があるとします。
覚えておいてくださいE2反応では、最初にすべてのβ水素を識別し、これらのβ水素の各セットに基づいて除去の生成物を描画します。

E2反応では、最初にすべてのβ水素を識別し、これらのβ水素の各セットに基づいて除去の生成物を描画します。 この場合、脱離基(Br)の右側と2つのメチル基にβ水素があります。

だから、一つの製品は、二重結合が中央にあるアルケンになるだろう:

一方、各メチル基の水素は、対称面とアルケンの構造/p>

興味深いのは、これら二つのアルケンのうちの一つだけが主要な生成物であることが判明していることです。 比率はより代わりにされたアルケンを支持して約80:20です:p>

この理由は、アルケンの安定性です。 より多くの置換されたアルケンがより安定していることを覚えておいてください。 二重結合上の基を追加すると、アルケンの安定性が向上します。

今、私たちの製品をチェックすると、それは二置換アルケンと三置換アルケンの混合物であり、三置換アルケンがこの脱離反応の主要な生成物であることがわかります:
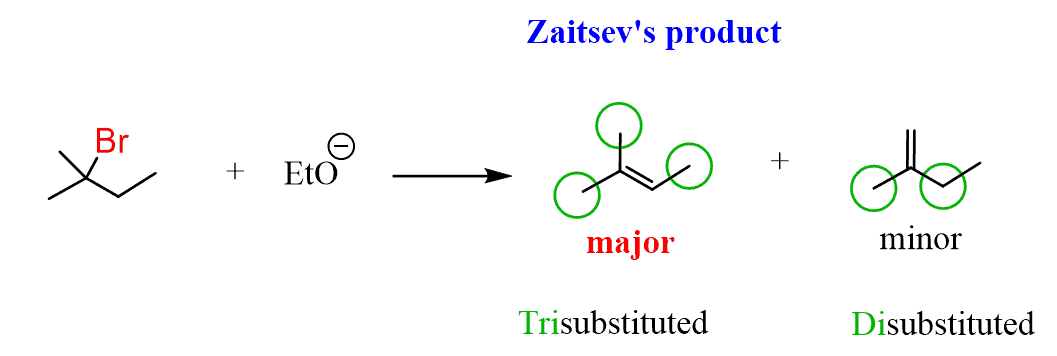
したがって、より置換されたアルケンは、その高い安定性のためにE2除去の主要な生成物である。
ロシアの化学者Alexander Zaitsevはこのパターンを観察した最初の人であり、反応は彼にちなんで命名されています。 ザイツェフの法則は、脱離反応では、より置換されたアルケンが主要な生成物であると述べている。
Zaitsevのルールは、E2反応で常に従われているわけではありません。
例えば、同じハロゲン化アルキルを、例えばカリウムtert-ブトキシドのような立体的に障害された塩基(大きく/かさばる)で処理すると、逆の傾向が見られます。
より少なく代わりにされたアルケンはより少なく安定しているという事実にもかかわらず主要なプロダクトです。

これは、ハロゲン化アルキル(または他の適切な基質)を強い立体的に妨げられた塩基で処理すると、主な生成物は置換されていないアルケンになると述べているホフマンの法則として知られている。
この理由は、かさばる塩基が他の炭素によって妨げられていない陽子にアクセスする方が簡単であるためです。
そして、メチル基のプロトンはCH2基のプロトンよりもアクセス可能であるため、置換されていないアルケンはより速く形成され、この場合の主要約すると、より置換されたアルケンが必要な場合は、立体的に妨げられていない塩基を使用してください。
要約すると、より置換されたアルケンが
lees置換アルケンが標的である場合は、立体的に阻害された塩基を使用する。

最も一般的な立体的に妨げられた塩基と妨げられていない塩基を上に示します。
これら二つのルールは、我々が合成したいアルケンを制御することができるので、有機合成に非常に適用可能です。 そしてこれらのアルケンは他のプロダクトを準備するために更に使用することができます。
E2反応の位置選択性
ザイツェフのルールとホフマンのルールは、除去反応における位置選択性の原則を示しています。
位置選択的反応が選択的に主要な生成物として一つの位置異性体を生成することを意味します。
位置選択的反応が選択的に主要な生成物 二重結合が異なる領域にあるため、2つのアルケンは位置異性体である。 それはこれを覚えているだけでなく、アルケンが憲法上の異性体であることに気づく一つの方法です。 したがって、位置選択性は、1つの構成異性体の好ましい形成である。