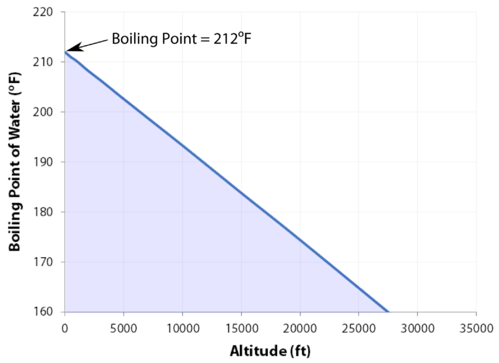
kookpunt
als een vloeistof wordt verhit, neemt de gemiddelde kinetische energie van de deeltjes toe. De snelheid van verdamping neemt toe naarmate meer en meer moleculen het oppervlak van de vloeistof in de dampfase kunnen ontsnappen. Uiteindelijk wordt een punt bereikt wanneer de moleculen door de hele vloeistof genoeg kinetische energie hebben om te verdampen. Op dit punt begint de vloeistof te koken. Het kookpunt is de temperatuur waarbij de dampdruk van een vloeistof gelijk is aan de externe druk. Onderstaande figuur illustreert het koken van vloeistof.
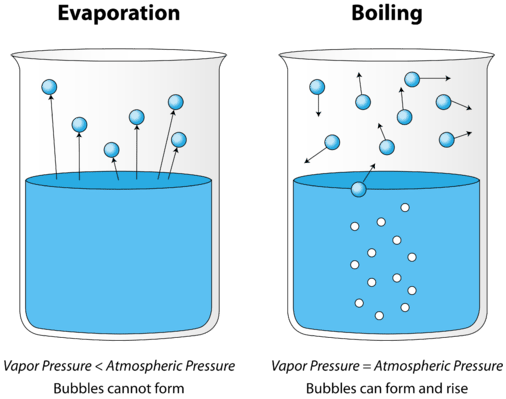
in de afbeelding links is de vloeistof onder het kookpunt, maar toch verdampt een deel van de vloeistof. Aan de rechterkant is de temperatuur verhoogd totdat er bellen beginnen te vormen in het lichaam van de vloeistof. Wanneer de dampdruk in de bel gelijk is aan de externe atmosferische druk, stijgen de bellen naar het oppervlak van de vloeistof en barsten. De temperatuur waarbij dit proces plaatsvindt is het kookpunt van de vloeistof.
het normale kookpunt is de temperatuur waarbij de dampdruk van de vloeistof gelijk is aan de standaarddruk. Omdat de atmosferische druk kan veranderen op basis van locatie, verandert het kookpunt van een vloeistof met de externe druk. Het normale kookpunt is een constante omdat het is gedefinieerd ten opzichte van de standaard atmosferische druk van \(760 \: \text{mm} \: \ce{Hg}\) (of \(1 \: \text{atm}\) of \(101.3 \: \text{kPa}\)).