redoxreacties gaan allemaal over de overdracht van elektronen van de ene stof naar de andere, dus het is nuttig om een systeem te hebben om bij te houden welke elektronen winnen en wat verliezen en hoeveel elektronen er bij betrokken zijn. Het registratiesysteem voor redoxreacties wordt oxidatiegetallen genoemd. Misschien herinner je je ook iets dat elektronegativiteit heet uit eerdere scheikundeles.
elektronegativiteit
Het vermogen van een gebonden atoom om gedeelde elektronen naar zichzelf aan te trekken.
wanneer twee atomen van verschillende elementen met elkaar verbonden zijn door een covalente binding (gedeelde elektronen), worden de elektronen over het algemeen niet gelijkelijk gedeeld tussen de twee atomen vanwege verschillen in hun elektronegativiteit. Zie dit als een touwtrekken voor elektronen. Soms trekken beide atomen met gelijke kracht op gedeelde elektronen; andere keren is er duidelijk een sterkere speler die de elektronen dichter bij zichzelf trekt.
beschouw de binding tussen een waterstofatoom (met één valentie-elektron) en een zuurstofatoom (met zijn zes valentie-elektronen):
|
|
+
|
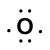 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to waterstofatoom. Dit is niet de totale overdracht van elektronen die een ion zou creëren, maar gedeeltelijke ladingen vormen. Het waterstofeinde van de binding is gedeeltelijk positief (+1) omdat het gedeeltelijk een elektron heeft verloren, en het zuurstofeinde van de H–O is gedeeltelijk negatief (-1) omdat het gedeeltelijk het ene elektron uit waterstof heeft gewonnen:
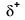 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
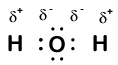
we zien dat elk van de twee waterstofatomen een elektron aan zuurstof heeft “verloren”. Zuurstof heeft “opgedaan” twee elektronen – een van elke waterstof. Nogmaals, dit zijn geen echte ionen, maar het is nuttig om ze op dezelfde manier te denken.
ladingen die op deze manier aan atomen in een molecuul worden gegeven, worden oxidatiegetallen genoemd. We kunnen oxidatiegetallen gebruiken om bij te houden waar elektronen zich in een molecuul bevinden en hoe ze bewegen tijdens een reactie. In ons watervoorbeeld krijgt waterstof een oxidatiegetal van +1 omdat elke afzonderlijke waterstof een elektron heeft “verloren”. Zuurstof heeft een oxidatiegetal van +2 omdat het enkele zuurstofatoom in totaal twee elektronen heeft” opgedaan”, één van elke waterstof.
Hier is een ander molecuul met waterstof en zuurstof—waterstofperoxide, H2O2:
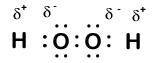
In waterstofperoxide heeft elke waterstof nog steeds een oxidatiegetal van +1 omdat elke waterstof een enkel elektron aan zuurstof “afgeeft”. Zuurstof, echter, heeft nu een oxidatiegetal van -1 omdat elke zuurstof krijgt slechts een elektron van zijn naburige waterstof. De elektronen tussen de twee identieke zuurstofatomen worden gelijkelijk gedeeld, dus er is geen gedeeltelijke lading als gevolg van die binding.
oxidatiegetal
een positief of negatief getal dat aan een atoom in een molecuul of ion wordt toegekend en dat een gedeeltelijke versterking of verlies van elektronen weerspiegelt.
Het kennen van het oxidatiegetal van elk individueel element in een molecuul zal een belangrijke stap zijn in ons begrip van redoxreacties. Gelukkig zal het gewoonlijk niet tekening elektron punt diagrammen impliceren. In plaats daarvan zijn er een reeks regels die we kunnen gebruiken om oxidatiegetallen te bepalen. Hier zijn de belangrijkste regels:
| het oxidatiegetal van een zuiver element (op zichzelf, en niet een ion) is nul. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal op zijn lading. alkalimetalen-elementen in de eerste kolom van het periodiek systeem—hebben altijd een oxidatiegetal van +1; Aardalkalimetalen (kolom 2) zijn bijna altijd +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
het oxidatiegetal van zuurstof is bijna altijd -2 wanneer het zich in een verbinding bevindt. de uitzonderingen:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
De som van de oxidatie nummers in een compound is nul. om het oxidatiegetal van Mn in Mn2O7 te bepalen, moeten we achterwaarts werken:
-2 × 7 atomen = -14 totaal aangezien de som van de oxidatiegetallen nul moet zijn, moet het totale oxidatiegetal van Mn +14 zijn om zuurstof ‘ s -14 te neutraliseren, maar aangezien er 2 Mn atomen zijn, zal elk afzonderlijk atoom een oxidatiegetal hebben van + 7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
De som van de oxidatiegetallen in een polyatomisch ion is gelijk aan de lading op dat ion. opnieuw terugwerken om het oxidatiegetal van een atoom zonder zuurstof of zonder waterstof te bepalen. om het oxidatiegetal van Cr in Cr2O72- :
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is belangrijk om op te merken dat oxidatiegetal altijd verwijst naar elk afzonderlijk atoom in de verbinding, niet naar het totaal voor dat element.
bijvoorbeeld, in H2O is de totale positieve” lading ” voor beide waterstofatomen +2 (die balanceert met de -2 uit zuurstof), maar elke waterstof heeft een oxidatiegetal van +1.
bijdragen & Attributies
deze pagina is opgebouwd uit Inhoud via de volgende contributor(s) en bewerkt (lokaal of uitgebreid) door het libretexts development team om te voldoen aan platformstijl, presentatie en kwaliteit:
-
CK-12 stichting door Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson en Jean Dupon.