leerdoelstellingen
- gebruik celnotatie om galvanische cellen te beschrijven
- Beschrijf de basiscomponenten van galvanische cellen\
galvanische cellen, ook bekend als voltaïsche cellen, zijn elektrochemische cellen waarin spontane oxidatie-reductiereacties elektrische energie produceren. Bij het schrijven van de vergelijkingen is het vaak handig om de oxidatie-reductiereacties te scheiden in halve reacties om de balans van de totale vergelijking te vergemakkelijken en de werkelijke chemische transformaties te benadrukken.
overweeg wat er gebeurt als een schoon stuk koper metaal wordt geplaatst in een oplossing van zilvernitraat (figuur \(\Paginindex{1}\)). Zodra het kopermetaal wordt toegevoegd, begint zilvermetaal te vormen en komen koperionen in de oplossing terecht. De blauwe kleur van de oplossing aan de rechterkant wijst op de aanwezigheid van koperionen. De reactie kan worden gesplitst in twee halfreacties. Halfreacties scheiden de oxidatie van de reductie, zodat elke reactie afzonderlijk kan worden beschouwd.
de vergelijking voor de reductiehalfreactie moest worden verdubbeld, zodat het aantal elektronen “gewonnen” in de reductiehalfreactie gelijk was aan het aantal elektronen “verloren” in de oxidatiehalfreactie.

galvanische of voltaïsche cellen impliceren spontane elektrochemische reacties waarbij de halfreacties worden gescheiden (figuur \(\Paginindex{2}\)) zodat stroom door een externe draad kan stromen. Het bekerglas aan de linkerkant van de figuur wordt een halve cel genoemd, en bevat een 1 M oplossing van koper(II) nitraat met een stuk koper metaal gedeeltelijk ondergedompeld in de oplossing. Het koper metaal is een elektrode. Het koper ondergaat oxidatie; daarom is de koperelektrode de anode. De anode is verbonden met een voltmeter met een draad en de andere terminal van de voltmeter is verbonden met een zilveren elektrode door een draad. Het zilver ondergaat reductie; daarom is de zilveren elektrode de kathode. De halfcel aan de rechterkant van de figuur bestaat uit de zilverelektrode in een 1 M oplossing van zilvernitraat (AgNO3). Op dit punt, geen stroomstromen—dat wil zeggen, geen significante beweging van elektronen door de draad optreedt omdat het circuit open is. Het circuit wordt gesloten met behulp van een zoutbrug, die de stroom doorstuurt met bewegende ionen. De zoutbrug bestaat uit een geconcentreerde, niet-reactieve elektrolytoplossing zoals de natriumnitraat (NaNO3) – oplossing die in dit voorbeeld wordt gebruikt. Als elektronen van links naar rechts door de elektrode en draad stromen, gaan nitraationen (anionen) door de poreuze stekker aan de linkerkant in de koper(II) nitraatoplossing. Hierdoor blijft het bekerglas links elektrisch neutraal door de lading op de koper(II) ionen die in de oplossing worden geproduceerd te neutraliseren als het kopermetaal wordt geoxideerd. Tegelijkertijd bewegen de nitraationen naar links, de natriumionen (kationen) naar rechts, door de poreuze plug, en in de zilvernitraatoplossing aan de rechterkant. Deze toegevoegde kationen “vervangen” de zilverionen die uit de oplossing worden verwijderd omdat ze tot zilvermetaal worden gereduceerd, waardoor de beker rechts elektrisch neutraal blijft. Zonder de zoutbrug zouden de compartimenten niet elektrisch neutraal blijven en zou er geen significante stroom stromen. Als de twee compartimenten echter in direct contact staan, is een zoutbrug niet nodig. Op het moment dat het circuit is voltooid, leest de voltmeter +0,46 V, Dit wordt de celpotentiaal genoemd. Het celpotentieel wordt gecreeerd wanneer de twee ongelijke metalen worden verbonden, en is een maat van de energie per eenheid lading beschikbaar van de oxidatie-reductiereactie. De volt is de afgeleide SI-eenheid voor elektrisch potentiaal
\
In deze vergelijking is A de stroom in ampère en C de lading in coulombs. Merk op dat volt moet worden vermenigvuldigd met de lading in coulombs (C) om de energie in joules (J) te verkrijgen.
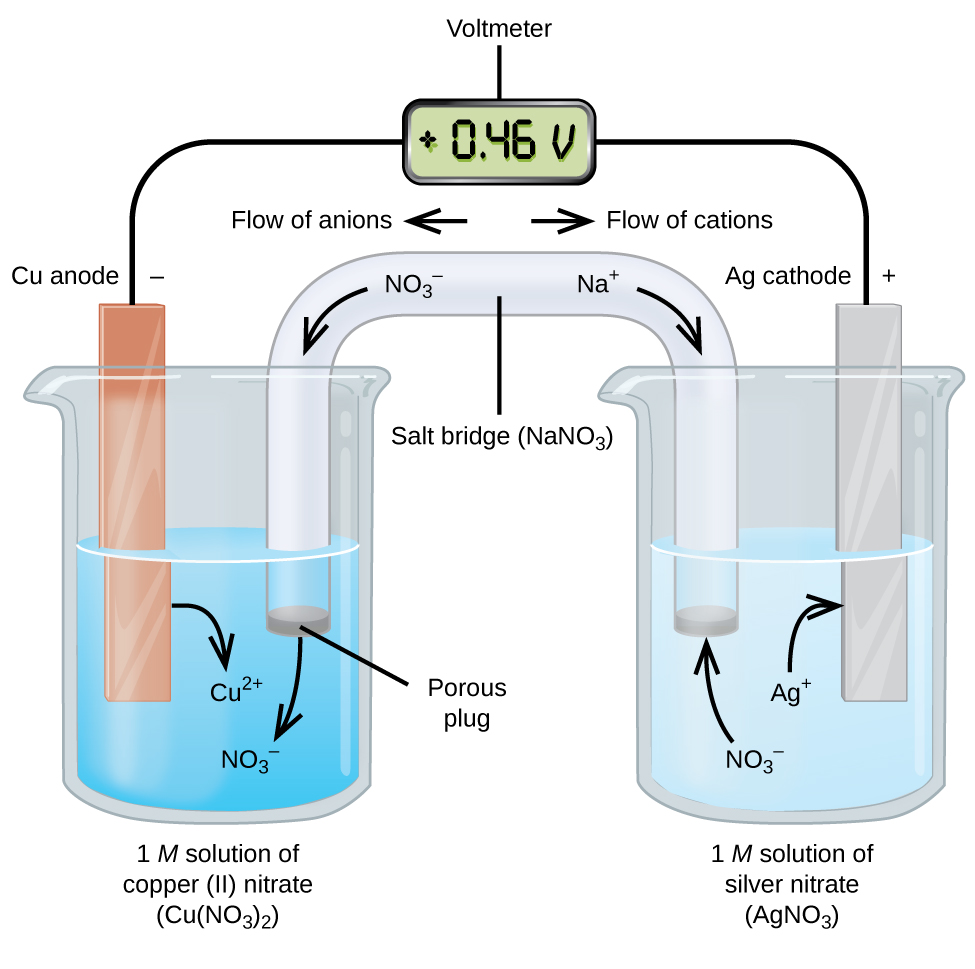
wanneer de elektrochemische cel op deze manier is geconstrueerd, duidt een positief celpotentiaal op een spontane reactie en dat de elektronen van links naar rechts stromen. Er is veel aan de hand in Figuur \(\Paginindex{2}\), dus het is handig om dingen voor dit systeem samen te vatten:
- elektronen stromen van de anode naar de kathode: van links naar rechts in de standaard galvanische cel in de figuur.
- de elektrode in de linkerhelft is de anode omdat hier oxidatie optreedt. De naam verwijst naar de stroom van anionen in de salt bridge naar het.
- de elektrode in de rechterhelft is de kathode omdat hier reductie optreedt. De naam verwijst naar de stroom van kationen in de zoutbrug.
- oxidatie vindt plaats op de anode (de linkerhelft in de figuur).
- reductie vindt plaats bij de kathode (de rechter halfcel in de figuur).
- het celpotentieel, +0,46 V, is in dit geval het gevolg van de inherente verschillen in de aard van de materialen die worden gebruikt om de twee halve cellen te maken.
- de zoutbrug moet aanwezig zijn om het circuit te sluiten (compleet) en zowel oxidatie als reductie moeten plaatsvinden om de stroom te laten stromen.
Er zijn veel mogelijke galvanische cellen, dus een steno-notatie wordt meestal gebruikt om ze te beschrijven. De celnotatie (soms genoemd een celdiagram) verstrekt informatie over de diverse species betrokken bij de reactie. Deze notatie werkt ook voor andere soorten cellen. Een verticale lijn,│, duidt een fasegrens aan en een dubbele lijn,‖, de zoutbrug. Informatie over de anode wordt naar links geschreven, gevolgd door de anode-oplossing, dan de zoutbrug (indien aanwezig), dan de kathode-oplossing, en ten slotte informatie over de kathode naar rechts. De celnotatie voor de galvanische cel in Figuur \(\Paginindex{2}\) is dan
\
merk op dat toeschouwer-ionen niet zijn opgenomen en dat de eenvoudigste vorm van elke halve reactie werd gebruikt. Wanneer bekend, zijn de beginconcentraties van de verschillende ionen meestal inbegrepen.
een van de eenvoudigste cellen is de Daniell-cel. Het is mogelijk om deze batterij te construeren door een koperen elektrode op de bodem van een pot te plaatsen en het metaal te bedekken met een kopersulfaatoplossing. Een zinksulfaat-oplossing wordt op de kopersulfaatoplossing gedreven; vervolgens wordt een zinkelektrode in de zinksulfaat-oplossing geplaatst. Door de koperelektrode te verbinden met de zinkelektrode kan een elektrische stroom stromen. Dit is een voorbeeld van een cel zonder een zoutbrug, en ionen kunnen over de interface tussen de twee oplossingen stromen.
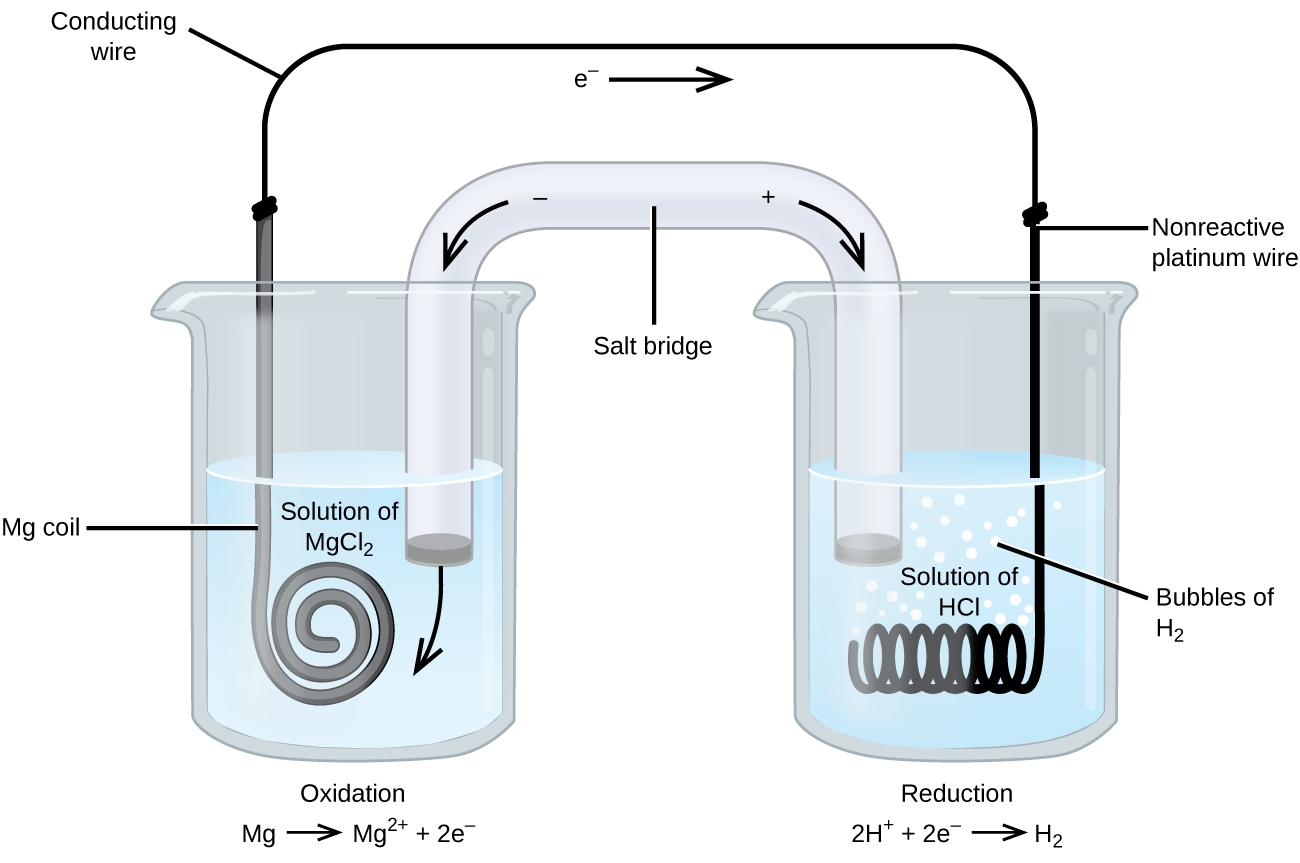
sommige oxidatiereacties hebben betrekking op soorten die slechte geleiders van elektriciteit zijn, en daarom wordt een elektrode gebruikt die niet aan de reacties deelneemt. Vaak is de elektrode platina, goud of grafiet, die allemaal inert zijn voor veel chemische reacties. Een dergelijk systeem wordt weergegeven in Figuur \(\Paginindex{3}\). Magnesium ondergaat oxidatie aan de anode links in de figuur en waterstofionen ondergaan reductie aan de kathode rechts. De reactie kan worden samengevat als
de cel gebruikt een inerte platinadraad voor de kathode, dus de celnotatie is
De magnesiumelektrode is een actieve elektrode omdat deze deelneemt aan de oxidatie-reductie reactie. Inerte elektroden, zoals de platina elektrode in Figuur \(\Paginindex{3}\), nemen niet deel aan de oxidatie-reductie reactie en zijn aanwezig zodat er stroom door de cel kan stromen. Platina of goud maken over het algemeen goede inerte elektroden omdat ze chemisch niet reactief zijn.
voorbeeld \(\Paginindex{1}\): met behulp van Celnotatie
beschouw een galvanische cel bestaande uit
\
schrijf de oxidatie-en reductiehalfreacties en schrijf de reactie met behulp van celnotatie. Welke reactie vindt plaats bij de anode? De kathode?
oplossing
door inspectie wordt Cr geoxideerd wanneer drie elektronen verloren gaan om Cr3+ te vormen, en Cu2+ wordt verminderd omdat het twee elektronen krijgt om Cu te vormen. Het balanceren van de lading geeft
\
Celnotatie gebruikt de eenvoudigste vorm van elk van de vergelijkingen, en begint met de reactie op de anode. Er werden geen concentraties gespecificeerd, dus:
\
oxidatie vindt plaats bij de anode en reductie bij de kathode.
voorbeeld \(\Pagindex{2}\): Met behulp van Celnotatie
beschouw een galvanische cel bestaande uit
schrijf de oxidatie-en reductiehalfreacties en schrijf de reactie met behulp van celnotatie. Welke reactie vindt plaats bij de anode? De kathode?
oplossing
door inspectie ondergaat Fe2 + oxidatie wanneer één elektron verloren gaat om Fe3+ te vormen, en wordt MnO4− gereduceerd omdat het vijf elektronen krijgt om Mn2+te vormen. Het balanceren van de lading geeft
\
Celnotatie gebruikt de eenvoudigste vorm van elk van de vergelijkingen, en begint met de reactie op de anode. Het is noodzakelijk om een inerte elektrode, zoals platina, te gebruiken omdat er geen metaal aanwezig is om de elektronen van de anode naar de kathode te geleiden. Er werden geen concentraties gespecificeerd, dus:
\
oxidatie vindt plaats bij de anode en reductie bij de kathode.
oefening \(\Pagindex{1}\)
gebruik celnotatie om de galvanische cel te beschrijven waar koper(II) ionen worden gereduceerd tot kopermetaal en zinkmetaal wordt geoxideerd tot zinkionen.
antwoord
uit de in het probleem gegeven informatie:
\
met behulp van celnotatie:
\
samenvatting
elektrochemische cellen bestaan doorgaans uit twee halve cellen. De halfcellen scheiden de oxidatiehaltereactie van de reductiehaltereactie en maken het mogelijk dat de stroom door een externe draad stroomt. Een halve cel, normaal aan de linkerkant afgebeeld in een figuur, bevat de anode. Oxidatie vindt plaats bij de anode. De anode is verbonden met de kathode in de andere halve cel, vaak weergegeven aan de rechterkant in een figuur. Reductie vindt plaats aan de kathode. Het toevoegen van een zoutbrug completeert het circuit waardoor de stroom kan stromen. Anionen in de zoutbrug stromen naar de anode en kationen in de zoutbrug stromen naar de kathode. De beweging van deze ionen maakt het circuit compleet en houdt elke halve cel elektrisch neutraal. Elektrochemische cellen kunnen worden beschreven gebruikend celnotatie. In deze notatie verschijnt links informatie over de reactie bij de anode en rechts informatie over de reactie bij de kathode. De zoutbrug wordt voorgesteld door een dubbele lijn, ‖. De vaste, vloeibare of waterige fasen binnen een halve cel worden gescheiden door een enkele lijn, │. De fase en concentratie van de verschillende soorten is opgenomen na de soortnaam. Elektroden die deelnemen aan de oxidatie-reductie reactie worden actieve elektroden genoemd. Elektroden die niet deelnemen aan de oxidatie-reductie reactie maar zijn er om stroom te laten stromen zijn inerte elektroden. Inerte elektroden worden vaak gemaakt van platina of goud, die onveranderd zijn door vele chemische reacties.
Woordenlijst
actieve elektrode elektrode die deelneemt aan de oxidatie-reductie reactie van een elektrochemische cel; de massa van een actieve elektrode verandert tijdens de oxidatie-reductie reactie anode elektrode in een elektrochemische cel waarin oxidatie optreedt; informatie over de anode wordt geregistreerd aan de linkerkant van de zoutbrug in cel notatie kathode elektrode in een elektrochemische cel waarbij reductie optreedt; informatie over de kathode wordt geregistreerd aan de rechterkant van de zoutbrug in cel notatie cel notatie steno manier om de reacties in een elektrochemische cel cel potentiaalverschil in elektrische potentiaalverschil dat ontstaat wanneer ongelijke metalen zijn aangesloten; de drijvende kracht voor de stroom van lading (stroom) in oxidatie-reductie reacties galvanische cel elektrochemische cel die een spontane oxidatie-reductie reactie impliceert; elektrochemische cellen met positieve cel potentialen; ook wel een voltaïsche cel inerte elektrode elektrode die stroom toelaat te stromen, maar die anderszins niet deelneemt aan de oxidatie-reductie reactie in een elektrochemische cel; de massa van een inerte elektrode verandert niet tijdens de oxidatie-reductie reactie; inerte elektroden zijn vaak gemaakt van platina of goud omdat deze metalen chemisch niet reactief zijn. voltaïsche cel een andere naam voor een galvanische cel
bijdragers en toeschrijvingen
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) en Richard Langley (Stephen F. Austin State University) met bijdragende auteurs. Tekstboek content geproduceerd door OpenStax College is gelicenseerd onder een Creative Commons Attribution License 4.0 licentie. Gratis downloaden op http://cnx.org/contents/85abf193-2bd…[email protected]).