De hybridisatietheorie wordt vaak gezien als een lang en verwarrend concept en het is een handige vaardigheid om snel te kunnen bepalen of het atoom sp3, sp2 of sp is zonder alle details te hoeven doornemen van hoe de hybridisatie had plaatsgevonden.
gelukkig is er een snelkoppeling in het doen van dit en in dit bericht, zal ik proberen om dit samen te vatten in een paar verschillende stappen die u moet volgen.
stel dat u gevraagd wordt om de hybridisatietoestand te bepalen voor de genummerde atomen in de volgende molecule:

het eerste wat u moet doen is het aantal groepen bepalen dat op elk atoom aanwezig is. Met groepen bedoelen we atomen of eenzame paren elektronen. Dit is ook bekend als het sterische getal (Sn).

hieronder vindt u een paar voorbeelden van sterische getallen 2-4, dat is grotendeels wat u moet weten in de organische chemie:

merk op dat meerdere bindingen er niet toe doen, het zijn atomen + eenzame paren voor elk bindingen type.
als je Eenmaal weet hoe om te bepalen van de sterische nummer (het is uit de VSEPR-theorie), je moet gewoon gelden de volgende correlatie:
Als de sterische nummer 4, het is sp3
Als de sterische nummer 3 – sp2
Als de sterische nummer 2 – sp
nu, laten we terug gaan naar onze molecuul en het bepalen van de hybridisatie staten voor alle atomen.
C1 – SN = 3 (drie atomen met elkaar verbonden zijn), dus het is sp2
C2 – SN = 3 (drie atomen met elkaar verbonden zijn), dus het is sp2
O4 – SN = 3 (1 atoom + 2 eenzame paren), dus het is sp2
O5 – SN = 4 (2 atomen + 2 eenzame paren), het is daarom sp3
C6 – SN = 4 (4 atomen), dus het is sp3
C7 – SN = 4 (4 atomen), dus het is sp3
N8 – SN = 4 (3 atomen + 1 alleenstaande paar), dus het is sp3
C9 – SN = 2 (2-atomen), daarom is de sp
C10 – SN = 2 (2-atomen), daarom is de sp

In aanvulling op deze methode, is het ook zeer nuttig om sommige eigenschappen met betrekking tot de structuur en kruising te herinneren. In het algemeen is een atoom met alle enkele bindingen een SP3 gehybridiseerd. Het beste voorbeeld zijn de alkanen. Alle koolstofatomen in een alkaan zijn SP3 gehybridiseerd met tetrahedrale geometrie.
de koolstofatomen in alkenen en andere atomen met een dubbele binding zijn vaak gehybridiseerd door sp2 en hebben een trigonale vlakke geometrie.
De drievoudige binding daarentegen is kenmerkend voor alkynen waar de koolstofatomen sp-gehybridiseerd zijn.
er zijn een paar veel voorkomende uitzonderingen op wat we hebben besproken over het bepalen van de hybridisatietoestand en ze zijn meestal gerelateerd aan de methode waar we kijken naar het bindingstype van het atoom.
bijvoorbeeld, in het koolstofdioxide (CO2) heeft de koolstof twee dubbele bindingen, maar het is sp-gehybridiseerd.
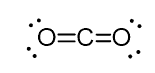
de reden hiervoor is het feit dat het sterische getal van de koolstof twee is (er zijn slechts twee zuurstofatomen aan verbonden) en om twee atomen op 180o te houden, wat de Optimale geometrie is, moet de koolstof twee identieke orbitalen gebruiken. Dit is alleen mogelijk in de SP hybridisatie. De andere twee 2P orbitalen worden gebruikt voor het maken van de dubbele bindingen aan elke kant van de koolstof.
een ander veel voorkomend en zeer belangrijk voorbeeld zijn de carbocaties.

Hier heeft de koolstof slechts enkele bindingen en kan het lijken alsof het SP3 gehybridiseerd moet zijn. Nochtans, is de koolstof in dit type van carbocations SP2 gekruist. Nogmaals, om dezelfde reden, dat het sterische getal 3 is (sp2-drie identieke orbitalen).
een uitzondering op de methode met het sterisch getal
een uitzondering met het sterisch getal is bijvoorbeeld de amiden. Het stikstofatoom hier heeft sterisch nummer 4 en naar verwachting sp3. Echter, vanwege de resonantie delokalisatie van het eenzame paar, het interconverteert van sp3 naar sp2 omdat het de enige manier om de elektronen in een uitgelijnde p orbitaal die kunnen overlappen en deelnemen aan resonantie stabilisatie met de pi binding elektronen van de C=O dubbele binding.

in de meeste gevallen hoeft u zich geen zorgen te maken over de uitzonderingen als u gaat op basis van het sterische getal.