mechanismen van enzymatische katalyse
de binding van een substraat aan de actieve plaats van een enzym is een zeer specifieke interactie. De actieve plaatsen zijn spleten of groeven op de oppervlakte van een enzym, gewoonlijk samengesteld uit aminozuren van verschillende delen van de polypeptideketen die in de tertiaire structuur van de gevouwen proteã ne worden samengebracht. De substraten binden aanvankelijk aan de actieve plaats door niet-kovalente interactie, met inbegrip van waterstofbanden, Ionische banden, en hydrophobic interactie. Zodra een substraat aan de actieve plaats van een enzym wordt gebonden, kunnen veelvoudige mechanismen zijn omzetting in het product van de reactie versnellen.
hoewel het eenvoudige voorbeeld dat in de vorige paragraaf werd besproken slechts een enkel substraatmolecuul betrof, impliceren de meeste biochemische reacties interacties tussen twee of meer verschillende substraten. Bijvoorbeeld, impliceert de vorming van een peptide band de verbinding van twee aminozuren. Voor dergelijke reacties versnelt de binding van twee of meer substraten aan de actieve plaats in de juiste positie en oriëntatie de reactie (figuur 2.23). Het enzym verstrekt een malplaatje waarop de reactanten worden samengebracht en correct worden georiënteerd om de vorming van de overgangstoestand te bevorderen waarin zij op elkaar inwerken.

figuur 2.23
enzymatische katalyse van een reactie tussen twee substraten. Het enzym verstrekt een malplaatje waarop de twee substraten in de juiste positie en oriëntatie worden samengebracht om met elkaar te reageren.
enzymen versnellen reacties ook door de conformatie van hun substraten te wijzigen om die van de overgangstoestand te benaderen. Het eenvoudigste model van enzym-substraat interactie is het lock-and-key model, waarin het substraat precies past in de actieve site (figuur 2.24). In veel gevallen, echter, worden de configuraties van zowel het enzym als het substraat gewijzigd door substraatbinding – een proces genoemd veroorzaakte pasvorm. In dergelijke gevallen wordt de bouw van het substraat zodanig gewijzigd dat het dichter op die van de overgangstoestand lijkt. De spanning die door een dergelijke vervorming van het substraat wordt veroorzaakt, kan zijn omzetting in de overgangstoestand verder vergemakkelijken door kritieke bindingen te verzwakken. Bovendien wordt de overgangstoestand gestabiliseerd door zijn strakke binding aan het enzym, waardoor de vereiste energie van activering wordt verlaagd.

figuur 2.24
modellen van interactie tussen enzym en substraat. (A) in het lock-and-key model past het substraat precies in de actieve plaats van het enzym. (B) in het induced-fit model verstoort substraatbinding de conformaties van zowel substraat als enzym. Deze vervorming (meer…)
naast het samenbrengen van meerdere substraten en het vervormen van substraten om de overgangstoestand te benaderen, nemen veel enzymen direct deel aan het katalytisch proces. In dergelijke gevallen, kunnen specifieke aminozuur zijketens in de actieve plaats met het substraat reageren en banden met reactie tussenproducten vormen. De zure en basische aminozuren zijn vaak betrokken bij deze katalytische mechanismen, zoals geïllustreerd in de volgende bespreking van chymotrypsine als voorbeeld van enzymatische katalyse.
chymotrypsine is een lid van een familie van enzymen (serineproteasen) die eiwitten verteren door de hydrolyse van peptidebindingen te katalyseren. De reactie kan als volgt worden geschreven:

de verschillende leden van de serine protease familie (waaronder chymotrypsine, trypsine, elastase en trombine) hebben verschillende substraatspecificaties; zij splitsen bij voorkeur peptide banden naast verschillende aminozuren. Bijvoorbeeld, terwijl chymotrypsine bindingen naast hydrophobic aminozuren, zoals tryptofaan en phenylalanine verteert, verteert trypsine bindingen naast basisaminozuren, zoals lysine en arginine. Alle serineproteasen, echter, zijn gelijkaardig in structuur en gebruiken hetzelfde mechanisme van katalyse. De actieve plaatsen van deze enzymen bevatten drie kritieke aminozuren-serine, histidine, en aspartaat—die hydrolyse van de peptideband drijven. Inderdaad, deze enzymen worden serine proteasen genoemd vanwege de centrale rol van het serine residu.
substraten binden zich aan de serineproteasen door het aan de splitsingsplaats grenzende aminozuur in een zak op de actieve plaats van het enzym te plaatsen (figuur 2.25). De aard van deze pocket bepaalt de substraatspecificiteit van de verschillende leden van de serine protease familie. Bijvoorbeeld, bevat de bindende zak van chymotrypsin hydrophobic aminozuren die met de hydrophobic zijketens van zijn aangewezen substraten in wisselwerking staan. In tegenstelling, bevat de bindende zak van trypsine een negatief geladen zuur aminozuur (aspartaat), dat een ionische band met de lysine of argininineresiduen van zijn substraten kan vormen.
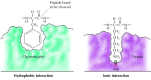
figuur 2.25
Substraatbinding door serineproteasen. Het aminozuur naast de te splitsen peptide band wordt ingebracht in een zak bij de actieve plaats van het enzym. In chymotrypsine, bindt de zak hydrophobic aminozuren; de bindende zak van trypsine bevat (meer…)
Substraatbinding plaatst de te splitsen peptidebinding naast het actieve siteserine (figuur 2.26). Het proton van dit serine wordt dan overgebracht naar de actieve plaats histidine. De bouw van de actieve plaats begunstigt deze protonoverdracht omdat histidine met het negatief geladen aspartaatresidu in wisselwerking staat. De serine reageert met het substraat en vormt een tetrahedrale overgangstoestand. De peptide band wordt dan gespleten, en het C-eindgedeelte van het substraat wordt vrijgegeven van het enzym. Nochtans, blijft N-eindpeptide gebonden aan serine. Deze situatie wordt opgelost wanneer een watermolecuul (het tweede substraat) de actieve plaats binnenkomt en de voorgaande reacties omkeert. Het proton van de watermolecule wordt overgebracht naar histidine, en zijn hydroxylgroep wordt overgebracht naar peptide, die een tweede tetrahedrale overgangstoestand vormen. Het proton wordt dan overgebracht van histidine terug naar serine, en peptide wordt vrijgegeven van het enzym, het voltooien van de reactie.

figuur 2.26
katalytisch mechanisme van chymotrypsine. Drie aminozuren op de actieve plaats (Ser-195, His-57, en Asp-102) spelen kritieke rollen in katalyse.
dit voorbeeld illustreert verschillende kenmerken van enzymatische katalyse; de specificiteit van enzym-substraatinteracties, de positionering van verschillende substraatmoleculen in de actieve plaats en de betrokkenheid van residuen op de actieve plaats bij de vorming en stabilisatie van de transitietoestand. Hoewel de duizenden enzymen in cellen vele verschillende soorten chemische reacties katalyseren, gelden dezelfde basisprincipes voor hun werking.