U. S. Pharm. 2008; 33 (4) (oncologie suppl): 20-30. ABSTRACT: ongeveer 75% van de postmenopauzale vrouwen met borstkanker heeft hormoonreceptorpositieve (HR+) ziekte.1 Tamoxifen was de norm van therapie voor HR+ borstkanker in postmenopausal vrouwen tot de komst van de selectieve inhibitors van derde generatie aromatase, die anastrozole, letrozole, en exemestane zijn.3,4 deze middelen hebben een superieure ziektevrije overleving aangetoond in klinische proeven vergeleken met tamoxifen, maar hun voordeel bij gebruik gedurende meer dan vijf jaar bij postmenopauzale vrouwen met HR+ borstkanker is niet vastgesteld.3,4
naar schatting heeft driekwart van de postmenopauzale vrouwen met borstkanker een hormoonreceptorpositieve (HR+) ziekte.1 Tamoxifen — een selectieve oestrogeen-receptormodulator met estrogenic gevolgen voor been, endometrial weefsel, en lipiden en anti!= estrogenic gevolgen voor borstweefsel — was de standaardtherapie voor HR + borstkanker in postmenopausal vrouwen tot de introductie van de selectieve inhibitors van derde generatie aromatase (AIs).2-4 deze agenten — anastrozole, letrozole, en exemestane — hebben superieure ziekte-vrije overleving (DFS) vergeleken met tamoxifen in klinische proeven aangetoond.3,4 bijwerkingen geassocieerd met het gebruik van tamoxifen–endometriumkanker, trombo-embolische complicaties, en tamoxifen weerstand–hebben de ontwikkeling van therapieën met een ander werkingsmechanisme, zoals AIs aangemoedigd.2
zie Tabel 1 voor een samenvatting van belangrijke informatie over de AIs van de derde generatie.
Achtergrond
De Schotse chirurg George Beatson beschreef in 1896 de hormonale bijdrage van oestrogenen aan carcinogenese in relatie tot borstkanker.5 deze chirurgisch veroorzaakte staat van oestrogeen ontbering bijgedragen aan de remming van tumorgroei in borstkanker cellen in vrouwen met HR+ ziekte.Aminoglutethimide, oorspronkelijk geformuleerd als een anticonvulsivum, was de eerste niet-specifieke AI die in de late jaren zeventig werd gepromoveerd als een tweedelijns middel na tamoxifen voor postmenopauzale vrouwen met gevorderde HR+ borstkanker.6 toxische bijwerkingen zoals bijnierafschaffing en de noodzaak voor steroid therapie leidden tot de terugtrekking van aminoglutethimide van de markt.6 bij postmenopauzale vrouwen met vroeg-en laat-stadium HR+ borstkanker, tonen de derde generatie AIs een beter toxiciteitsprofiel, meer selectiviteit, hogere potentie, en verbeterde klinische werkzaamheid in vergelijking met de oudere middelen. 6
Classificatie4,7
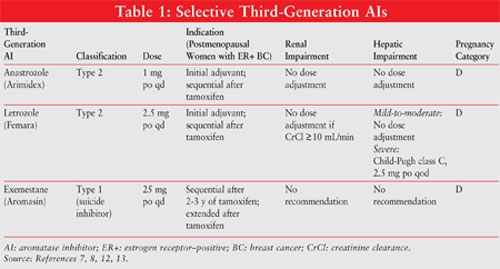
AIs worden geclassificeerd als type 1 steroïdale (niet-competitieve, irreversibele) of type 2 niet-steroïdale (competitieve, reversibele) remmers. Exemestane, een type 1 inhibitor, bindt irreversibel aan de plaats op de aromatasemolecule en staat bekend als zelfmoordinhibitor. De type 2 inhibitors anastrozole en letrozole binden omkeerbaar aan aromatase. Zie figuur 1 voor de chemische structuren van de verschillende AIs.
Mechanisme van Actie
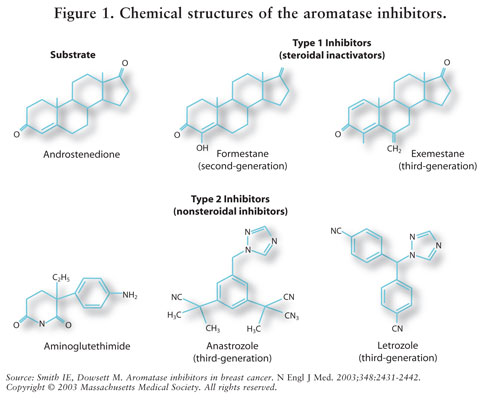
Oestrogeen synthese wordt gemedieerd door het enzym aromatase.7 Aromatase zet androstenedione en testosteron om in estrone en estradiol.5,7 AIs vermindert oestrogeen bij postmenopauzale vrouwen, waardoor het carcinogene effect op borstweefsel wordt geremd.7 omdat de eierstokken van premenopausal vrouwen nog functioneren, zijn AIs niet aangewezen voor deze bevolking buiten klinische proeven; in deze vrouwen, zou AIs de hypothalamus en de hypofyse stimuleren om productie van gonadotropins te verhogen.4 Zie figuur 2.
Toxiciteiten6,8
bijwerkingen van AIs zijn cardiovasculaire disfunctie zoals hypertensie, vasodilatatie, oedeem en pijn op de borst. Verder onderzoek is vereist om het volledige effect van AIs op de hartfunctie te evalueren. Patiënten kunnen een verminderde botmineraaldichtheid (BMD), een verhoogd risico op fracturen, vasomotorische symptomen, vaginale droogheid, spier-en skeletpijn, hoofdpijn, slapeloosheid, depressie, toegenomen hoest, dyspnoe, gastro-intestinale klachten, gewichtstoename en mogelijk verhoogde lipidenspiegels ervaren. Botverlies is een overheersende bijwerking; bisfosfonaten zoals zoledroninezuur zijn gebruikt om dit tegen te gaan. Patiënten die AIs gebruiken, moeten vitamine D en calciumsupplementen krijgen. Langdurige bijwerkingen en effecten op de cognitieve functie van AI-therapie zijn nog niet vastgesteld.AIs zijn gecontra-indiceerd bij zwangere vrouwen. Anastrozol remt CYP1A2, CYP2C9 en CYP3A4.10,11 Letrozol wordt gemetaboliseerd door CYP2A6 en CYP2C19 en exemestaan metaboliseert CYP3A4.8,10-13 inductoren van CYP3A4 zoals rifampine, fenytoïne, carbamazepine en sint-janskruid kunnen bij gelijktijdige toediening een verlaging van de exemestaanspiegels veroorzaken. 8,12,13 Tamoxifen veroorzaakt een 38% daling van letrozol en een 27% daling van Anastrozol wanneer gelijktijdig beheerd.Anastrozol 10,11: Anastrozol 1 mg eenmaal daags is geïndiceerd voor vroege borstkanker als initiële adjuvante therapie bij postmenopauzale vrouwen met hormonaal gevoelige ziekte en als eerste lijn voor HR+ of HR-Onbekende gemetastaseerde of lokaal gevorderde ziekte. Het is ook goedgekeurd voor gebruik na tamoxifen therapie bij vrouwen met progressieve ziekte. Aanpassing van de dosis is niet nodig bij een nierfunctiestoornis of een lichte tot matige leverfunctiestoornis.
Letrozole11, 12: Letrozol 2.5 mg eenmaal daags is geïndiceerd voor postmenopauzale vrouwen met HR+ vroeg stadium borstkanker als initiële therapie of als verlengde adjuvante therapie na tamoxifen. Het is ook geïndiceerd voor HR+ of HR-Onbekende metastatische ziekte. Dosisaanpassingen worden aanbevolen bij ernstige leverinsufficiëntie.
Exemestane11,14: exemestaan 25 mg po eenmaal daags is geïndiceerd als adjuvante therapie twee tot drie jaar na tamoxifen voor postmenopauzale vrouwen met HR+ vroege borstkanker, gedurende in totaal vijf opeenvolgende jaren hormonale therapie. Het kan ook worden gebruikt voor ziekte die is gevorderd na tamoxifen therapie. Het moet na een maaltijd worden ingenomen. Dosisaanpassing is niet nodig bij lever-of nierfunctiestoornissen
klinische onderzoeken
Tamoxifen-gerelateerde toxiciteiten zoals endometriumkanker leidden tot de start van grootschalige klinische onderzoeken waarin het gebruik van AIs van de derde generatie werd onderzocht bij postmenopauzale vrouwen met HR+ borstkanker. Verschillende proefontwerpen werden gebruikt om de prestaties van deze agenten te beoordelen die met tamoxifen worden vergeleken.6 superieure resultaten in termen van klinische effectiviteit en toxiciteit profielen vastgesteld AIs als een nieuwe standaard van adjuvante therapie bij postmenopauzale vrouwen met HR+ borstkanker.ATAC15: ATAC (Arimidex, Tamoxifen alleen of in combinatie), een multicenter, gerandomiseerd, dubbelblind onderzoek, vergeleek drie behandelingsarmen: tamoxifen 20 mg + anastrozol placebo, anastrozol 1 mg + tamoxifen placebo, en een combinatie van tamoxifen 20 mg + anastrozol 1 mg. Het primaire doel was om de veiligheid en werkzaamheid van tamoxifen versus anastrozol en de combinatie van Anastrozol en tamoxifen meer dan vijf jaar te evalueren. Een totaal van 9.366 patiënten — 3.125 in de anastrozol-arm, 3.116 in de tamoxifen-arm, en 3.125 in de combinatie-arm–werden behandeld voor een mediaan van 33 maanden.
na drie jaar vertoonde anastrozol DFS van 89,4% versus 87,4% voor tamoxifen (hazard ratio 0,83, 95% BI, P =.013). Anastrozol verlaagde het percentage contralaterale borstkanker (CLBC) in vergelijking met tamoxifen (odds ratio 0,42, 95% BI , P =.007). De combinatiearm werd gesloten omdat er geen klinisch voordeel werd gevonden buiten tamoxifen. Anastrozol werd geassocieerd met bijwerkingen zoals endometriumkanker (P =.02), vaginale bloeding, afscheiding (P <.0001), cerebrovasculaire voorvallen (P =.0006), veneuze trombo-embolische voorvallen (P=.0006), en opvliegers (P <.0001); tamoxifen werd geassocieerd met minder fracturen en minder gewrichtspijn (P <.0001). Na 68 maanden verhoogde anastrozol DFS (HR 0,87, 95% BI, P=.01) en tijd tot recidief (HR 0,79; 95% BI, P=.0005) en verminderde verre metastasen (HR 0,86, 95% BI , P =.04) en CLBC (42% daling, P =.01).Na een mediaan follow-up interval van 100 maanden vertoonden HR+ – patiënten op anastrozol verbeteringen in DFS (HR 0,85; P =.003), voorkomen van CLBC (HR 0,60, P =.004) , tijd tot recidief (HR 0,76, P=.0001), en tijd tot verre herhaling (HR 0,84, P=.022) vergeleken met patiënten die tamoxifen kregen. Het absolute verschil in recidiefpercentages Verbeterde van 2.8% na vijf jaar tot 4,8% na negen jaar. Het aantal anastrozolfracturen was hoger tijdens de behandeling, maar het verschil nam aanzienlijk af na de follow-upperiode van 100 maanden. De verlengde therapie periode had een risico op fractuur van 1,15 met anastrozol versus 1,02 met tamoxifen. Het risico van endometriumkanker was verminderd on en off anastrozol therapie vergeleken met tamoxifen, met een jaarlijks tarief van 0,033 versus 0,14 en 0,014 versus 0,12, respectievelijk. Een verschil in totale overleving (OS) is niet vastgesteld.
MA.1712,17: MA.17 was een gerandomiseerde, placebogecontroleerde, dubbelblinde studie die de effectiviteit van vijf jaar letrozol therapie bij postmenopauzale vrouwen met borstkanker beoordeelde die reeds vijf jaar adjuvante tamoxifen therapie hadden voltooid. Patiënten kregen dagelijks letrozol 2,5 mg of placebo gedurende vijf jaar. Het primaire eindpunt was DFS; secundaire eindpunten waren kwaliteit van leven, uitgebreid veiligheidsprofiel en OS. Van de 5187 patiënten kregen 2.593 letrozol en 2.594 placebo; mediane follow-up was 2,4 jaar.
in de voorlopige analyse waren er 207 lokale of gemetastaseerde recidieven van borstkanker of initiële maligniteiten van CLBC, 75 in de letrozol-groep en 132 in de placebogroep. Voor de twee groepen waren de verwachte DFS-percentages voor vier jaar respectievelijk 93% en 87% (P ?.001 voor evaluatie van DFS). In de letrozol-arm had DFS een HR van 0,61 (95% BI, P ?.001). Letrozol toonde een daling van 43% in de incidentie van borstkanker (HR 0,57, 95% BI, P=.00008).4 met uitzondering van klierpositieve patiënten (P=.04), bereikte OS geen statistische significantie (HR 0,82, P =.30).4 patiënten in de letrozol-arm ondervonden laaggradige vasomotorische symptomen, myalgie en artritis. Osteoporose kwam vaker voor (hoewel niet significant) in de letrozol-arm versus placebo (5,8% Versus 4,5%; P =.07), en de mate van fractuur was vergelijkbaar tussen de armen. Het onderzoek werd na een mediaan van 2,4 jaar gesloten vanwege een afname van borstkanker in de letrozol-arm. Uitgebreide adjuvante therapie met letrozole na voltooiing van vijf jaar tamoxifen verbeterde DFS.
BIG 1-987,9,18: De Breast International Group (BIG) 1-987 studie, een dubbelblinde, multicenter, gerandomiseerde studie, omvatte 8.028 postmenopauzale vrouwen met HR+ vroeg stadium borstkanker. De studie omvatte vier behandelingsarmen die vijf jaar van tamoxifen monotherapie, vijf jaar van letrozole monotherapie, tamoxifen twee jaar toen een schakelaar aan Letrozole drie jaar, of letrozole twee jaar toen een schakelaar aan tamoxifen drie jaar evalueerden. De primaire doelstelling was DFS; secundaire doelstellingen waren tijd tot verre metastase, veiligheid, en OS. DFS nam toe bij patiënten die letrozol kregen in vergelijking met degenen die tamoxifen kregen (HR 0,81, 95% BI , relatieve reductie 19%, P =.003), met een absoluut verschil van 1,5% na drie jaar. Tamoxifen verhoogde het optreden van trombo-embolische voorvallen in vergelijking met letrozol (of 0,38, P <.0001). Botfracturen namen toe in de letrozol-arm (of 1,44, P =.006).
IES14, 19: De IES (Intergroup Exemestane Study) was een gerandomiseerde, dubbelblinde, multicenter, Fase III studie waarvan het doel was om te bepalen of het veranderen naar exemestane na twee tot drie jaar tamoxifen effectiever was dan het voortzetten van tamoxifen gedurende vijf jaar. Aan het onderzoek namen 4.742 postmenopauzale vrouwen deel die gerandomiseerd waren naar twee behandelingsarmen; 2.362 proefpersonen waren gepland om over te schakelen op exemestane 25 mg po qd na twee tot drie jaar tamoxifen 20 mg po qd om vijf jaar behandeling te voltooien, en de resterende 2.380 waren gepland om tamoxifen 20 mg po qd gedurende vijf jaar te krijgen. DFS was het primaire eindpunt; secundaire eindpunten waren OS, Uitgebreid toxiciteitsprofiel en frequentie van CLBC.
bijwerkingen, die optraden over een mediaan van 30,6 maanden, omvatten frequentie van CLBC, lokaal of gemetastaseerd recidief en overlijden. Er waren 449 gebeurtenissen–183 in de exemestane arm en 266 in de tamoxifen arm. De exemestaanarm had een niet-aangepaste HR van 0,68 (95% BI , P <.001 volgens de log-rank test), die een daling van het risico van 32% aantoonde en analoog was aan een voordeel in DFS van 4.75 (95% BI) na drie jaar. Na drie jaar had de exemestaan-arm een DFS van 91,5% (95% – BI ) vergeleken met 86,8% (95% – BI ) in de tamoxifen-arm. Er was geen significant verschil in OS tussen de twee groepen, met 93 sterfgevallen in de exemestaan-arm en 106 sterfgevallen in de tamoxifen-arm. Er was een significant verschil in de frequentie van CLBC (P =.04) — 20 proefpersonen in de tamoxifen-arm en negen in de exemestaan-arm. Het gebruik van exemestane om de vijf jaar van behandeling na twee tot drie jaar van tamoxifen te voltooien verbeterde DFS in vergelijking met vijf jaar van tamoxifen.
preventie van botverlies door AI-therapie 20
postmenopauzale vrouwen zijn gevoelig voor het ontwikkelen van een verlaagde BMD vanwege verminderde oestrogeenspiegels. AI-therapie bij de postmenopauzale borstkankerpatiënt verergert deze tendens. Denosumab, een volledig humaan monoklonaal onderzoeksantilichaam, bindt receptoractivator voor nucleaire factor kB ligand (RANKL) en voorkomt RANKL-activiteit. RANKL is essentieel voor de osteoclastische activiteit, wat de afbraak van bot betekent. Denosumab en risedronaat, een bisfosfonaat, worden onderzocht op hun vermogen om botverlies geassocieerd met AI-therapie tegen te gaan.
denosumab Onderzoek20: een Multicenter, gerandomiseerd, Fase III onderzoek evalueerde het gebruik van denosumab 60 mg subcutaan toegediend eens per zes maanden bij postmenopauzale vrouwen die AIs kregen voor HR+ niet-metastatische borstkanker. Het doel was om de verandering in de BMD van de lumbale wervelkolom vanaf baseline tot 12 maanden te beoordelen. Van de 252 patiënten kregen 127 denosumab en 125 placebo. Beide armen kregen calcium en vitamine D. BMD werd geëvalueerd door middel van dual-energy X-ray absorptiometrie. Na 12 en 24 maanden behandeling met denosumab of placebo was er een verschil van respectievelijk 5,5% en 7,6% in BMD toename in het gebied van de lumbale wervelkolom in het voordeel van denosumab (P <.0001 Voor beide maanden). Denosumab vertoonde een vergelijkbaar toxiciteitsprofiel ten opzichte van placebo. Behandeling met Denosumab gedurende meer dan 24 maanden is nog niet beoordeeld.
IBIS-II Bone substudie 21: De International Breast Cancer Intervention Study-II (IBIS-II) Bot substudie werd afgeleid van IBIS-II, die postmenopauzale vrouwen met een verhoogde kans op het ontwikkelen van borstkanker evalueerde die gedurende vijf jaar gerandomiseerd waren aan anastrozol of placebo. De substudie, met een huidige deelname van 700 patiënten, evalueert risedronaat versus placebo voor de preventie van BMD-verlies bij vrouwen met lage T-scores bij baseline. Een subgroep van patiënten uit het IBIS-II-onderzoek werd toegewezen aan een van de drie verschillende behandelingsstrategieën in het subonderzoek. Na één jaar behandeling kregen 350 anastrozol-en 350 placebopatiënten van IBIS-II substudies. Stratum 1 omvatte 227 patiënten op anastrozol met normale T-scores (T-score ?1), bestond stratum 2 80 patiënten met osteopenie (ñ2. 5 ? T-score <1) die werden toegewezen aan risedronaat 35 mg eenmaal per week of placebo, en stratum 3 bestond uit 43 patiënten met osteoporose (ñ4 <T-score <2,5) die werden toegewezen aan risedronaat 35 mg eenmaal per week.
bij patiënten met osteopenie of osteoporose bij baseline bleek risedronaat botverlies geassocieerd met anastrozol te remmen. In stratum II vertoonde risedronaat gunstige effecten op het behoud van de BMD voor de totale heup, maar niet voor de lumbale wervelkolom (P =.005 en P =.15, respectievelijk vs. placebo). Er werden geen ernstige bijwerkingen of geneesmiddelinteracties in verband gebracht met risedronaat.
onderzoek met AIs bij premenopauzale vrouwen (SOFT)21-26
ongeveer 33% van de vrouwen jonger dan 50 jaar zal worden gediagnosticeerd met invasieve borstkanker. De suppressie van ovariale functie studie (SOFT, IBCSG 24-02, BIG 2-02) onderzoekt het gebruik van AI therapie bij premenopauzale vrouwen met HR+ borstkanker. De studie, die een gerichte patiënt inschrijving van 3.000 heeft, omvat premenopauzale vrouwen met HR + borstkanker die chemotherapie hebben voltooid of die slechts chirurgie hebben ontvangen. De ovariale ablatie wordt gevestigd door beleid van triptorelin (een gonadotropin-bevrijdend hormoon) eens maandelijks vijf jaar, chirurgische oophorectomy, of bekkenbestraling. De patiënten worden gerandomiseerd naar één van de drie armen, waarbij de eerste arm gedurende vijf jaar eenmaal daags tamoxifen krijgt, de tweede arm gedurende vijf jaar tamoxifen in combinatie met ovariale ablatie en de derde arm exemestaan gedurende vijf jaar in combinatie met ovariale ablatie. De patiënten zullen exemestane of tamoxifen vijf jaar ontvangen.
chemopreventie Trials23-27
Tamoxifen is geïndiceerd voor chemopreventie bij borstkanker.Het toxiciteitsprofiel is een oorzaak van beperking met betrekking tot therapeutisch gebruik.6 AIs kan de incidentie van HR+ borstkanker bij patiënten met een hoog risico verminderen vanwege een afname van de incidentie van CLBC in vergelijking met tamoxifen in klinische studies zoals ATAC.6
AI chemoprevention studies omvatten de International Breast Cancer Study Group (IBCSG) trial 31-03 (IBCSG 31-03) en de National Cancer Institute of Canada ‘ s MAP.3 proef. De primaire doelstelling van de multicenter, internationale, gerandomiseerde, placebo-gecontroleerde ibcsg 31-03 studie is het evalueren van het gebruik van Anastrozol voor de preventie van borstkanker bij postmenopauzale vrouwen. De primaire uitkomstmaat is de incidentie van invasieve en niet-invasieve borstkanker; de secundaire uitkomstmaat is de incidentie van osteoporose en fracturen.5 de IBCSG 31-03 trial heeft een doelinschrijving van 6.000. kaart.3 onderzoek evalueert exemestaan als chemopreventief middel bij postmenopauzale vrouwen. Het primaire doel van de placebogecontroleerde kaart.3 het onderzoek is bedoeld om de werkzaamheid van exemestaan in het verminderen van de incidentie van invasieve borstkanker te beoordelen.
mogelijke toekomstige toepassingen: casusrapporten
Letrozol werd gebruikt nadat clomifeen de vruchtbaarheid niet induceerde bij 22 vrouwen met polycysteus ovariumsyndroom. Letrozole veroorzaakte ovulatie in 75% van cycli versus 44.4% van cycli die door clomiphene worden veroorzaakt. Vier zwangerschappen resulteerden uit de ovulaties veroorzaakt door letrozol, en geen significante nadelige gevolgen werden geassocieerd met letrozol.28,29
een 57-jarige Zwaarlijvige vrouw met endometriose na hysterectomie en bilaterale salpingo-ooforectomie kreeg anastrozol na megestroltherapie. De patiënt had na negen maanden geen endometriumlaesies.28,30
een patiënt met het syndroom van McCune-Albright kreeg anastrozol voor een premature puberteit; de oestradiol van de patiënt normaliseerde na 2,5 jaar anastrozol en de botleeftijd werd met zes maanden verhoogd.28,31 verhoogd oestrogeen kan gynaecomastie en hypogonadotroop hypogonadisme induceren.28,31 het verminderen van oestrogeen met AI resulteerde in normaal gonadotropin en testosteron in mannetjes met gynaecomastie en hypogonadotroop hypogonadisme. 28,31,32
Letrozol werd onderzocht bij patiënten met recidiverend ovariumcarcinoom; de patiënten die letrozol kregen, hadden stabilisatie van de ziekte.28,33 neoadjuvant letrozol werd gegeven aan 10 postmenopauzale vrouwen met endometriumkanker; het medicijn vertoonde constructieve klinische veranderingen en had geen negatieve chirurgische impact.28,34
wanneer de behandeling met testolacton versus anastrozol werd vergeleken bij onvruchtbare mannen, was de werkzaamheid van de twee middelen vergelijkbaar.28,35 patiënten met het syndroom van Klinefelter kregen een effectievere behandeling met testolacton dan met anastrozol.28,35
conclusies
De derde generatie AIs vertoonde superieure DFS bij postmenopauzale vrouwen met HR+ borstkanker, maar het klinische voordeel van meer dan vijf jaar AI-therapie bij deze patiënten is niet vastgesteld.4 de National Surgical Adjuvant Breast and Bowel Project (NSABP) B-33 (exemestane) trial en een daaropvolgende randomisatie van de MA.17 (letrozole) proef zal het gebruik van deze AIs versus placebo voor een extra vijf jaar onderzoeken.4 AIs is een geschikt alternatief voor HR+ postmenopauzale vrouwen bij wie tamoxifen gecontra-indiceerd is.4
de gunstige effecten van de derde generatie AIs omvatten een toleranter toxiciteitsprofiel en superieure DFS vergeleken met tamoxifen. Het niveau van werkzaamheid tussen deze agenten en tamoxifen is vergelijkbaar. Er blijft onzekerheid bestaan over de gekozen behandelingsduur, het toxiciteitsprofiel op lange termijn en de juiste toedieningsvolgorde voor AIs.4 De nieuwe studies zijn nodig om selectieve aromatasemodulators te produceren die minder giftigheid dan AIs zullen veroorzaken.25,36-37
1. Robertson JFR. Fulvestrant (FaslodexÆ)–Hoe maak je een goede drug beter. Oncoloog . 2007;12:774-784.
2. Osborne CK. Medicamenteuze behandeling: tamoxifen bij de behandeling van borstkanker. N Engl J Med. 1998;339:1609-1618.
3. National Cancer Comprehensive Network. NCCN clinical practice guidelines in oncology — V. 1.2008. Borstkanker. www.nccn.org/professionals/physician_gls/f_guidelines.asp. Geraadpleegd op 11 oktober 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Preventie van hormoongerelateerde kanker: borstkanker. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. Aromatase inhibitors in breast cancer. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Aromataseremmers bij de behandeling en preventie van borstkanker. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, eds. Drug Information Handbook. 13e ed. Hudson, OH: Lexi-Comp; 2005: 117.598.871.
9. Ellis MJ, ed. Aromataseremmers voor de behandeling van borstkanker. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Arimidex (anastrozol) bijsluiter. Wilmington, DE: AstraZeneca Pharmaceuticals LP; mei 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id = 148&show=dept&artikel_id=9884. Geraadpleegd Op 17 Maart 2008.
14. Aromasin (exemestaan) bijsluiter. New York, New York: Pfizer Inc; Februari 2007.
15. Baum M, Budzar AU, Cuzick J, et al, voor de Atac Trialists ‘ Group. Anastrozole alleen of in combinatie met tamoxifen versus tamoxifen alleen voor adjuvante behandeling van postmenopausal vrouwen met vroege borstkanker: eerste resultaten van de gerandomiseerde studie ATAC. Lancet. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al, voor de Atac Trialists ‘ Group. Resultaten van de Atac (Arimidex, Tamoxifen, alleen of in combinatie) studie na voltooiing van 5 jaar adjuvante behandeling voor borstkanker. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino s, et al. Een gerandomiseerde proef van letrozole in postmenopausal vrouwen na vijf jaar van tamoxifen therapie voor kanker van de vroege stadium van de borst. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS, et al, voor de Breast International Group (BIG) 1-98 Collaborative Group. Een vergelijking van letrozole en tamoxifen in postmenopausal vrouwen met vroege borstkanker. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, voor de Intergroup Exemestane Study. Een gerandomiseerde proef van exemestane na twee tot drie jaar tamoxifen therapie in postmenopausal vrouwen met primaire borstkanker. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. Een fase 3-studie naar het effect van denosumab-therapie op de botmineraaldichtheid bij vrouwen die aromataseremmers krijgen voor niet-gemetastaseerde borstkanker. Paper presented at: the 30th Annual San Antonio Breast Cancer Symposium; 13-16 December, 2007; San Antonio, TX. Abstract 47.
21. Singh S, Cuzick J, Edwards R, et al. Effect van Anastrozol op de botmineraaldichtheid na één jaar behandeling: resultaten van bot substudie van de International Breast Cancer Intervention Study (IBIS-II). Paper gepresenteerd op: de 30e jaarlijkse San Antonio Breast Cancer Symposium; 13-16 December, 2007; San Antonio, TX. Abstract 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. adjuvante endocriene therapie voor premenopauzale vrouwen met vroege borstkanker. J Clin Oncol. 2005;23:1736-1750.
23. National Cancer Institute. Behandeling van borstkanker (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. Geraadpleegd op 26 December 2007.
24. Baylor College Of Medicine klinische proeven. Suppressie van ovariële functie studie (SOFT). www.breastcenter.tmc.edu/clinic/trials/soft.htm. Geraadpleegd op 26 December 2007.
25. Aebi S, Castiglione-Gertsch M. adjuvante endocriene therapie voor de zeer jonge patiënten. Borst. 2003;12:509-515.
26. ClinicalTrials.gov. afschaffing van ovariale functie plus of tamoxifen of exemestane wordt vergeleken met tamoxifen alleen in het behandelen van premenopausal vrouwen met hormoon-ontvankelijke borstkanker. www.clinicaltrials.gov/. Geraadpleegd op 26 December 2007.
27. Cuzick J. Aromataseremmers voor preventie van borstkanker. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, OruÁ S, Koyuncu FM. Aromataseremmers: mogelijke toekomstige toepassingen. Acta Verloskundige Gynaecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Gebruik van een aromataseinhibitor voor inductie van ovulatie in patiënten met een ontoereikende reactie op clomifeencitraat. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Rol van aromatase in endometriumziekte. J Steroid Biochem Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Gebruik van aromataseremmers in de vroegrijpe puberteit. Endocr Gerelateerd Aan Kanker. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K, et al. Oestrogeenovermaat geassocieerd met nieuwe gain-of-function mutaties die het aromatasegen beïnvloeden. N Engl J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP, et al. De reactie van ca 125 wordt geassocieerd met de uitdrukking van de oestrogeenreceptor in een Fase II studie van letrozol in eierstokkanker: identificatie van een endocriene gevoelige subgroep. Clin Cancer Res. 2002; 8: 2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Neoadjuvante therapie van endometriumkanker met de aromataseremmer letrozol: endocriene en klinische effecten. EUR J Verloskundige Gynaecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Aromataseremmers voor mannelijke onvruchtbaarheid. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. Aromatase and its inhibitors: significance for breast cancer therapy. Recent Prog Horm Res. 2002; 57: 317-338.