delokalisatie vindt plaats wanneer elektrische lading over meer dan één atoom wordt verspreid. Bijvoorbeeld, kunnen de verbindende elektronen over verscheidene atomen worden verdeeld die samen worden verbonden.

Voorbeeld 1:
een van de bekendste voorbeelden van een molecuul waarin bindingselektronen worden gedelokaliseerd is benzeen, hieronder weergegeven:
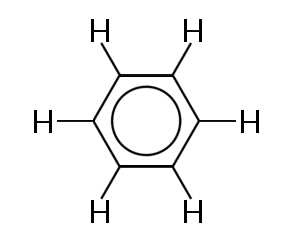
benzeen bestaat uit een ring van zes koolstofatomen. De koolstofatomen zijn allemaal SP2 gehybridiseerd met een ongehybride p orbitaal.
De SP2 hybride orbitalen produceren normale covalente bindingen, ook wel σ-bindingen genoemd: dit zijn de enkelvoudige C-C-bindingen en enkelvoudige C-H-bindingen.
Dit laat elke koolstof met een elektron in een P-baan onder een rechte hoek met het vlak van de ring.
in het onderstaande diagram zie je links de SP2 orbitalen die covalente bindingen vormen. Rechts zie je de p-orbitalen, die elk een elektron bevatten.
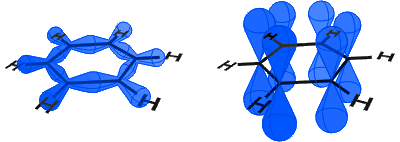
De p-orbitalen combineren side on en de elektronen in de p-orbitalen worden beschreven als π-elektronen.
in het onderstaande diagram zijn de p-orbitalen gecombineerd en worden De π-elektronen gedelokaliseerd. Gemiddeld zijn alle ringbanden identiek.
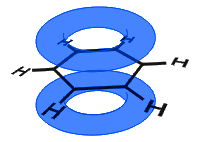
In tegenstelling tot in het volgende voorbeeld hieronder, worden de gedelokaliseerde elektronen in benzeen in het molecuul gehouden en zijn ze niet vrij om door het bulkmateriaal te bewegen.
Voorbeeld 2:
metalen hebben een hoge thermische en elektrische geleidbaarheid omdat de buitenste elektronen in hun atomen zijn gedelokaliseerd. Deze elektronen zijn niet geassocieerd met een bepaalde metaalkern, en zijn dus vrij om door het metaal te bewegen.
Erkenning: de blauwgekleurde afbeeldingen van de orbitalen van benzeen zijn met dank aan Sansculotte. Deze afbeeldingen zijn gelicenseerd onder de Creative Commons Naamsvermelding-Gelijk delen 1.0 Generieke licentie.