een voltaïsche cel, vaak bekend als een galvanische cel, levert elektrische energie. De bron van deze energie is een spontane chemische reactie, meer bepaald een spontane redoxreactie.
alle batterijen zijn bijvoorbeeld gemaakt van een of meer voltaïsche cellen;batterijen gaan plat wanneer de meeste of alle reactanten zijn omgezet in producten, waardoor hun chemische potentiële energie wordt omgezet in elektrische energie.
voltaïsche cellen-het basisproces
chemische potentiële energie → elektrische energie
De voltaïsche cel is een van de twee basistypes van elektrochemische cellen.Het andere type is de elektrolytische cel; in een elektrolytische cel wordt elektrische energie gebruikt om een niet-spontane chemische reactie aan te drijven.Water kan bijvoorbeeld worden gesplitst in waterstof en zuurstof in een elektrolytische cel. Wanneer een oplaadbare batterij wordt opgeladen, werkt deze ook als een elektrolytische cel.
Basisvoltaïsche Celschema

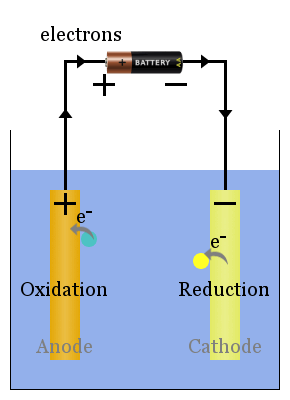
spontane redoxreacties bij de elektroden veroorzaken een spanning.Correct ingesteld, kan deze spanning elektronen door elektrische apparaten, zoals de gloeilamp weergegeven here.In in dit diagram brengen soorten elektronen over naar de anode van waar ze door de gloeilamp naar de kathode stromen, waar ze reductie veroorzaken.
Basiselektrolytische Celschema
niet-spontane redoxreacties worden aangedreven door een externe spanning.De processen van de elektrolytische cel zijn het tegenovergestelde van die van de voltaïsche cel.de stroom van de krachtbron duwt elektronen op de kathode, waar ze leiden tot vermindering van soorten plaatsvinden.
Lees hier meer over kathoden en anodes in voltaïsche Versus elektrolytische cellen.
voorbeeld van een voltaïsche cel
de Edison-batterij
De Edison-batterij is een eenvoudige, oplaadbare cel uitgevonden door Thomas Edison.It bestaat uit twee metalen elektroden, een Gemaakt van ijzer, de andere van nikkel.Tijdens het eerste Laden vormt zich een coating van nikkeloxide op de nikkelelektrode.
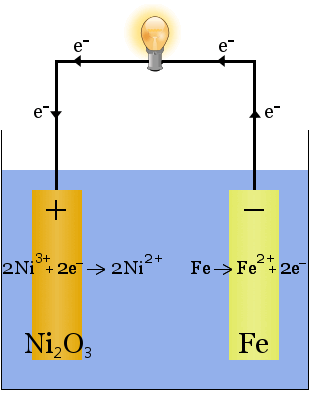
de elektrolyt (de ionische vloeistof tussen de elektroden) is 20-30 gewichtspercenten kaliumhydroxide in water.De rol van het kaliumhydroxide in dit geval is om de Ionische geleidbaarheid te verhogen om het elektrische circuit te voltooien – kaliumhydroxide wordt niet verbruikt in de reactie.
wanneer het ontlaadt, werkt de Edison-cel als een voltaïsche cel.Wanneer het wordt opgeladen, werkt de cel als een elektrolytische cel.
de chemische vergelijkingen voor de reacties bij de elektroden zijn:
tijdens de ontlading, wanneer de cel elektrische energie levert, gaan de reacties hierboven naar rechts →.
tijdens het laden, wanneer de cel elektrische energie omzet in chemische potentiële energie, gaan de reacties hierboven naar links ←.
De Edison-cel, waarvan beide elektroden dezelfde elektrolyt delen, is een van de eenvoudigste voltaïsche cellen in de praktijk; de meeste voltaïsche cellen zijn ingewikkelder.De grote voordelen zijn de opmerkelijke robuustheid tegen fouten zoals overbelading en de zeer lange levensduur, met bijna onbeperkte laad-ontlaadcycli.
het grootste nadeel is dat het, in verhouding tot zijn energie-output, zeer zwaar is.
verder voorbeeld
lithiumbatterijen
vooruitgang in de batterijtechnologie heeft geleid tot miniaturisatie van elektronische apparaten.Zonder deze vooruitgang zouden moderne apparaten zoals mobiele telefoons en tablets groter en omslachtiger zijn.
de kern van deze ontwikkelingen was de lithium-ion-technologie.Het element lithium is een metaal met een zeer lage dichtheid: bij 0,534 g/cm3 is lithium half zo dicht als water; lithium drijft op water.Vergelijk dit met de metalen in de Edison cel, nikkel dichtheid is 8.908 g/cm3, en ijzer is 7.874 g / cm3: deze zijn meer dan 10x hoger dan lithium dichtheid.het hoge redoxpotentieel van
Lithium in combinatie met de lage dichtheid maakt de ionen perfect voor gebruik als batterijmateriaal.
een typische lithium-ionbatterij is gebaseerd op poreuze elektroden die Li-ionen in en uit hun poriën laten bewegen.Een oplaadbare lithium-ionbatterij zou bijvoorbeeld een grafietelektrode kunnen hebben en een met lithium gedoteerde kobaltoxide gedoteerde elektrode met een polyoxyethyleenelektrolyt dat het Zoutlipf6 bevat.
wanneer een dergelijke batterij een apparaat van stroom voorziet, worden lithiumatomen in de laagstructuur van grafietanode geoxideerd tot ionen.
aan de kathode worden lithiumionen gereduceerd binnen de kobaltoxydestructuur.
These reactions are reversed when the cell is being charged.
