een goed uitgangspunt voor wanneer je de elektronenconfiguratie van een ion moet vinden is de elektronenconfiguratie van het neutrale atoom.
In uw geval moet u de elektronenconfiguratie van het fluoride-anion vinden, # ” F ” ^ ( -)#, dus begin met het schrijven van de elektronenconfiguratie van een neutraal fluor-atoom, #”F”#.
Fluor bevindt zich in Periode 2, groep 17 van het periodiek systeem en heeft een atoomnummer #9#. Dit vertelt je dat het neutrale fluor atoom een totaal van# 9 # elektronen rond zijn kern heeft.
zijn elektronenconfiguratie zal
# ” F:”1s^2 2s^2 2p^5#
nu wordt het #” F ” ^ ( -)# anion gevormd wanneer #1# elektron wordt toegevoegd aan een neutraal fluor-atoom.
merk op dat de 2P-subschelp van het neutrale atoom #5# elektronen bevat. De maximale capaciteit is eigenlijk # 6 # elektronen, twee elektronen voor elke p-orbitaal.
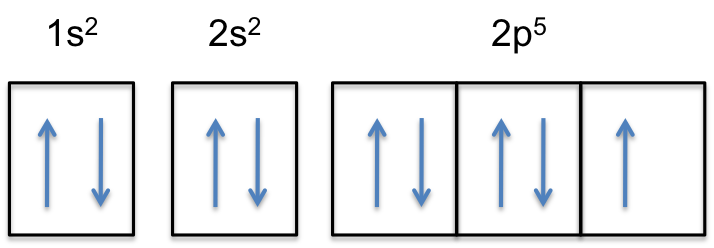
Dit betekent dat de # kleur (rood) (“extra elektron”)# zal worden toegevoegd aan een van de drie 2p-orbitalen, laten we zeggen #2p_y#.
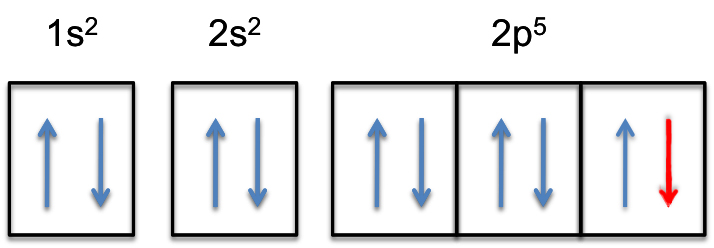
De 2P-subschelp zal nu volledig gevuld zijn, d.w.z. het zal #6# elektronen bevatten.
de elektronenconfiguratie van het fluoride-anion zal dus
#color(green)(|bar(ul(color(white)(a/a)color(black) (“F”^( -):color(white)(A) 1s^2color(white)(A) 2s^2 color(white)(a)2p^6)color(white)(a/a)|))#
merk op dat het fluoride-anion een totaal van #8# elektronen heeft in zijn tweede schil, de buitenste schil. Dit vertelt je dat het anion een compleet octet heeft.
omdat het fluoride-anion ISO – elektronisch is met neon, #”Ne”#, kunt u zijn elektronenconfiguratie schrijven met behulp van de notatie edelgas als
#”F”^ ( – ): #
Hier
## – de elektronenconfiguratie van neon