Wat is het redoxpotentieel van een cel?
Reader Mode
Redoxpotentialen worden gebruikt om de vrije energie kosten en richting van reacties met elektronenoverdracht te karakteriseren, een van de meest alomtegenwoordige en belangrijke biochemische reacties. Dergelijke vermindering-oxidatiereacties worden gekenmerkt door een vrije energieverandering die sommige conceptuele eigenschappen deelt met die wordt gebruikt om pKa in zuur-base reacties te beschrijven waar protonoverdracht eerder dan elektronenoverdracht betrokken is. In dit vignet, een van de meest abstracte in het boek, bespreken we hoe het redoxpotentiaal kan worden gebruikt als maatstaf voor de drijvende kracht voor een bepaalde oxidatie-reductie reactie van belang. Bij wijze van contrast, in tegenstelling tot de pH, is er geen zin in die men één enkel redoxpotentiaal aan een volledige cel kan toewijzen.
het redoxpotentiaal, of beter gezegd het reductiepotentiaal, van een verbinding verwijst naar zijn neiging om elektronen te verwerven en daardoor te worden verminderd. Sommige lezers herinneren zich misschien de ezelsbrug “OILRIG” die ons eraan herinnert dat “oxidatie verlies is, vermindering is winst”, waar het verlies en de winst zijn van elektronen. Overweeg een reactie die een elektronenoverdracht impliceert: Aox + ne – ↔ Ared waar n elektronen door de geoxideerde vorm (Aox) worden opgenomen om de verminderde vorm (Ared) van verbinding A te geven. Het redoxpotentiaal verschil ΔE tussen de elektronendonor en de acceptor is gerelateerd aan de bijbehorende vrije energieverandering ΔG van de reactie via ΔG=nFΔE waarbij n het aantal overgedragen elektronen is en F de constante van Faraday is (96.485 J/mol/V of ≈100 kJ/mol/V). Door getabelleerde waarden van deze potentialen te inspecteren, is het mogelijk een intuïtie te ontwikkelen voor de neiging tot elektronenoverdracht en dus voor de richting van de reactie.

figuur 1: een” redoxtoren ” die het redoxpotentieel van vaak voorkomende metabole halfreacties laat zien. De metabolische processen kunnen als bewegende elektronen tussen molecules worden gezien, die vaak wat van de energie vangen die wordt vrijgegeven aangezien de elektronen van hoge energie aan lagere energietoestanden zoals in glycolyse of ademhaling bewegen. Elektronen die door de “half-reacties” bovenop worden geschonken kunnen in een half-reactie lager op de toren worden verbruikt om een thermodynamisch gunstige reactie te voltooien. Bijvoorbeeld, impliceert het netto proces van glycolyse de oxidatie van glucose aan pyruvate aan de vermindering van nad+ aan nadh wordt gekoppeld. Aangezien de oxidatie van glucose aan de bovenkant van de toren ligt en de vermindering van NAD+ eronder is, is deze elektronenstroom thermodynamisch gunstig. In vergelijking met de ATP hydrolyse schaal bar kunnen we ook zien dat deze elektronenstroom gunstig genoeg is om ATP te produceren. De aërobe ademhaling impliceert vele intermediaire elektronentransfers door de elektronentransportketen. Verscheidene van deze overgangen worden getoond, met inbegrip van de oxydatiesuccinaat aan fumaraat die mechanistisch aan de vermindering van ubiquinone aan ubiquinol in de binnenste mitochrondral membranen wordt gekoppeld. Elk van deze tussenliggende elektronentransfers moet thermodynamisch gunstig zijn op zichzelf om de ademhaling verder te laten gaan. Door te vergelijken met de” ATP hydrolysis scale ” kunnen we zien dat de individuele transformaties in de elektronentransportketen niet energetisch genoeg zijn om ATP zelf te genereren. Toch zijn ze gunstig genoeg om een proton over de cel of mitochondriale membraan te pompen. Dit is de energetische basis voor chemiosmose: cellen slaan energiequanta op die te klein is voor ATP-synthese in de protongradiënt over een membraan. Die energie wordt later gebruikt om ATP te genereren door de H+ gradiënt om te zetten in fosfoanhydride bindingen op ATP via het ATP synthase.
hoewel ATP vaak wordt beweerd de energievaluta van de cel te zijn, zijn in feite voor de Energetische balans van de cel de dragers van het reductievermogen zelf niet minder belangrijk. Het belangrijkste voorbeeld van deze dragers is de molecule NADH in zijn verminderde of geoxideerde (NAD+) vormen. We kunnen het redoxpotentieel gebruiken om deze twee moleculaire protagonisten te verbinden, en een bovengrens schatten van het aantal ATP-moleculen dat kan worden geproduceerd door de oxidatie van NADH (geproduceerd, bijvoorbeeld in de TCA-cyclus). Het nad+/NADH-paar heeft een redoxpotentiaal van E = -0,32 V en het wordt geoxideerd door zuurstof om water (protonen afkomstig van de media) te geven met een redoxpotentiaal van E = +0,82 V. Beide zijn weergegeven in Figuur 1 als onderdeel van een “redoxtoren” van belangrijke biologische halfreacties die kunnen worden gekoppeld aan het vinden van de totale redoxpotentiaal verandering en dus de vrije energie. Voor de reactie beschouwd als hierboven van NADH oxidatie door zuurstof, de maximale geassocieerd gratis energie die kan worden gewonnen is dus
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
waar n=2 en F≈100kJ/mol/V. Als ATP hydrolyse heeft een vrije energie verandering van ≈50kJ/mol onder fysiologische condities vinden we dat 228 kJ/mol volstaat het om te produceren een maximum van 228/50≈4.5 ATPs. In de cel verloopt de oxidatie van NADH door verschillende stappen in de ademhaling en resulteert in de overdracht van 10 protonen over het membraan tegen het elektrochemische potentieel (BNID 101773). Deze proton transfers komen overeen met een andere manier om biochemische energie op te vangen. Deze energie wordt dan gebruikt door ATPase om 2-3 ATPs te produceren. Wij vinden zo dat ongeveer de helft van de energie die in de overdracht van elektronen van NADH aan zuurstof werd vrijgegeven in ATP wordt behouden. Om ervoor te zorgen dat de reactie op een gerichte manier plaatsvindt om ATP te produceren in plaats van het te consumeren, moet een deel van de energie “verspild” worden omdat het systeem uit evenwicht moet zijn.
waarom zou men het redoxpotentieel van halve reacties moeten bespreken en niet vrije energieën van volledige reacties? De eenheden zelf danken hun oorsprong aan het vermogen op het gebied van de elektrochemie om in het lab het spanningsverschil, d.w.z. het in volt gemeten potentieel, te meten over twee kamers die verschillende elektronendragers bevatten, en om de netreactie met een spanning te stoppen. Het nut van redoxpotentialen voor halve reacties ligt in het vermogen om combinaties van verschillende donoren en acceptoren te assembleren om de thermodynamische haalbaarheid en energiewinst van elke overwogen reactie te beoordelen. Als je k mogelijke elektronenoverdrachtsamenstellingen hebt, kunnen de ~k2 mogelijke reacties worden voorspeld op basis van alleen de k redoxpotentialen.
net zoals we spreken van de pH van een oplossing, zouden we ons op het eerste gezicht kunnen voorstellen dat het mogelijk zou zijn om te spreken van een schijnbaar analoog redoxpotentieel van de cel. Het kennen van de concentratie van de gereduceerde en geoxideerde vormen van een bepaald reactiepaar definieert hun pool redoxpotentiaal via de relatie
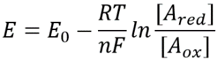
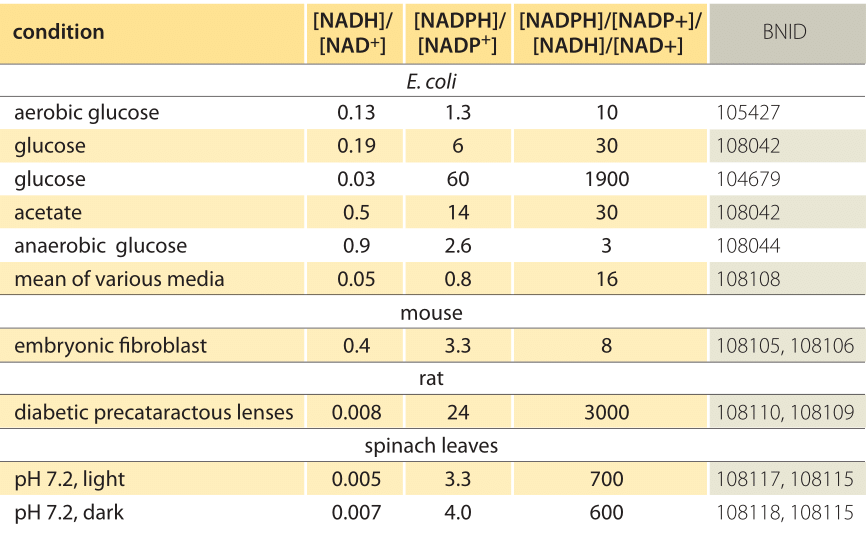
Tabel 1: concentratieverhoudingen van de gemeenschappelijke elektronendonorparen NAD/NADH en NADP/NADPH. Zoals te zien is de eerste relatief geoxideerd en de tweede relatief verminderd met een verhouding tussen hen meestal veel groter dan 1.
deze vergelijking (een zogenaamde Nernst-vergelijking) geeft de waarde van het redoxpotentiaal onder concentratieomstandigheden die kenmerkend zijn voor de cel in tegenstelling tot de standaardtoestandsomstandigheden (waarbij per definitie =). Als voorbeeld, overweeg de donatie van een elektron aan NAD+ resulterend in de geoxideerde vorm NADH. In de mitochondriale matrix wordt een verhouding van 10 maal meer van de geoxideerde vorm gerapporteerd (BNID 100779) zoals weergegeven in Tabel 1. In dit geval vinden we dat de factor ≈30 mV is en dus verandert de redoxpotentiaal van -0,32 V naar -0,29 V. Om er zeker van te zijn dat de richting van het effect die we kregen verstandig is, merken we dat bij een overvloed van de geoxideerde vorm de neiging om geoxideerd te worden door zuurstof iets lager is, gezien het feit dat de redoxpotentiaal nu dichter is dan voorheen bij die van het zuurstof/water elektron uitwisselende paar (+0,82 V).
een cel is niet in evenwicht en er is een zwakke koppeling tussen verschillende redoxparen. Deze situatie leidt tot de oprichting van verschillende redoxpotentialen voor coëxisterende redoxparen in de cel. Als de productie-en gebruiksstromen van de gereduceerde en geoxideerde vormen van een redoxpaar, Ared en Aox en een ander gefokt en Box, veel groter zijn dan hun interconversieflux, Ared+Box<>AOX+gefokt, dan kunnen A en B zeer verschillende redoxpotentiëlen hebben. Dientengevolge is het slecht bepaald om over het algemene redoxpotentieel van de cel te vragen aangezien het voor verschillende componenten binnen de cel verschillend zal zijn. Bij wijze van contrast is de pH van de cel (of van een compartiment daarin) veel beter gedefinieerd omdat water dient als het universele medium dat de verschillende zuur-base reacties koppelt en wat bekend staat als het chemische potentieel van alle soorten equilibreert.
voor een gegeven redoxpaar in een bepaald celcompartiment schrijft de concentratieverhouding van de twee vormen het redoxpotentiaal op een duidelijk gedefinieerde manier voor. Verbindingen die snel elektronen uitwisselen zullen in relatief evenwicht zijn en dus een vergelijkbaar redoxpotentiaal delen. Om te zien hoe deze ideeën uitspelen, is het dus het nuttigst om een redoxpaar te overwegen dat aan vele belangrijke cellulaire reacties deelneemt en, dientengevolge, nauw met de redoxstaat van vele samenstellingen verwant is. Glutathion in het cytoplasma is zo ‘ n verbinding als het neemt deel aan de vermindering en oxidatie van de zeer overwegende thiolbindingen (die die zwavel bevatten) in cysteine aminozuren van vele proteã nen. Glutathione is een tripeptide (samengesteld uit 3 aminozuren), centrale een cysteïne die in een verminderde (GSH) of geoxideerde vorm kan zijn waar het een dimeer met een cysteïne van een ander glutathionmolecuul (aangeduid GSSG) vormt. De halfreactie voor glutathion is dus 2 x GSH <> GSSG + 2e– + 2H+. De andere halfreactie is vaak een zwavelbinding die wordt “geopend” in een receptief eiwit waardoor in de gereduceerde vorm wordt gehouden als gevolg van de constante werking van glutathion. Glutathione is ook een dominante speler in het neutraliseren van reactieve samenstellingen die een hoge neiging hebben om elektronen te rukken en zo andere molecules te oxideren. Dergelijke verbindingen worden gemaakt onder oxidatieve spanning zoals bijvoorbeeld wanneer de capaciteit van de reacties van de elektronenoverdracht van ademhaling of fotosynthese wordt bereikt. Collectief genoemd ROS (reactieve zuurstofspecies) kunnen zij ravage in de cel veroorzaken en in vele processen van het verouderen worden betrokken. De dubbele rol van glutathione in het houden van proteã nen behoorlijk gevouwen en het beperken van ROS evenals zijn vrij hoge concentratie en de reactiviteit van de elektronenoverdracht maken tot het de eerste proxy voor de redoxstaat van de cel. De concentratie van glutathion in de cel is ≈10mM (BNID 104679, 104704, 111464), waardoor het de tweede meest voorkomende metaboliet in de cel (na glutamaat) die ervoor zorgt dat het een dominante rol speelt als elektronendonor in redoxcontrole van eiwitfunctie. In andere functies van cellen zijn er andere dominante elektronenparen. In biosynthetische anabole reacties is het NADP+/NADPH paar en in afbraak katabole reacties is het NAD+ / nadh.
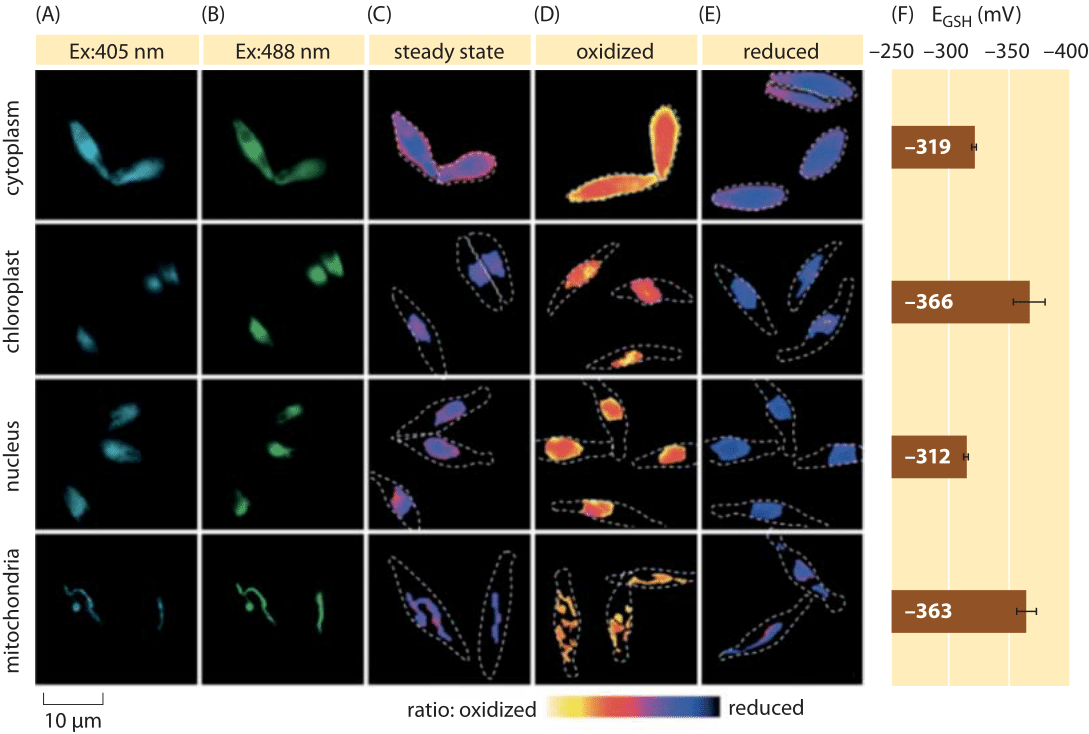
Figuur 2: Imaging of subcellular redox potential of the glutathion pool in diatomee algen in vivo. De weergave van de fluorescentiemicroscopie van P. tricornutum cellen die roGFP2 in diverse subcellular lokalisaties uitdrukken. De fluorescentiebeelden bij twee opwindingsgolflengten (A, B), werden verdeeld om ratiometrische waarden (C) te verkrijgen. Voor kalibratie worden ratiometrische beelden vastgelegd onder sterke oxidant (150 mM H2O2) (D) en reductant (1 mM DTT) (E) omstandigheden. Gestippelde lijnen vertegenwoordigen de omtrek van de cellen, getekend op basis van de heldere veldafbeeldingen. F) Het Steady-state redoxpotentiaal van de glutathionpool, EGSH in mV, werd berekend op basis van de Nernst-vergelijking met behulp van het oxidatieniveau onder bepaalde pH-waarden voor elke organel. Bewerking van: S. Graff van Creveld et al., ISME J., 9: 385, 2015.
Hoe gaat men om met het meten van redoxpotentialen in levende cellen? Nog een andere begunstigde van de fluorescente eiwitrevolutie was het onderwerp van redoxpotentialen. Een verslaggever GFP werd ontworpen om redox gevoelig door integratie van cysteine aminozuren te zijn die de fluorescentie beà nvloeden die op hun vermindering door de glutathionpool wordt gebaseerd. Figuur 2 toont het resultaat van het gebruik van een dergelijke reporter om te kijken naar de glutathion redox potentiaal in verschillende compartimenten van een diatomee.
uit metingen van de redoxtoestand van de glutathionpool in verschillende cellulaire organellen en onder verschillende omstandigheden kunnen we de verhouding van concentraties van de gereduceerde tot geoxideerde vormen afleiden. De waarden variëren van ongeveer -170 mV in de ER en in apoptotische cellen tot ongeveer -300 mV in de meeste andere organellen en in proliferatiecellen (BNID 103543, 101823, 111456, 111465). Aangezien het standaard redoxpotentieel van glutathion -240 mV (BNID 111453, 111463) is, wat is dan de verhouding van gereduceerd tot geoxideerd glutathion? Met behulp van de Nernst-vergelijking (of gelijkwaardig, uit de Boltzmann-verdeling) komt een tienvoudige verandering in de verhouding product/reactant overeen met een toename van ≈6 kJ/mol in vrije energie (≈2 kBT). Gezien de 2 elektronen die in de GSH/GSSG-reactie worden overgebracht is deze verandering van de concentratieverhouding gewoonlijk gelijk aan 30mV, hoewel voor glutathion, de stoichiometrie van 2 GSH molecules die tot één GSSG covalent-gebonden molecuul fuseren dit slechts een benadering maakt. De verandering van 100 mV die over voorwaarden wordt gerapporteerd weerspiegelt een verhouding van concentraties tussen ongeveer gelijke hoeveelheden van de verminderde en geoxideerde vormen (in apoptotische cellen) aan meer dan 1.000 vouw meer concentratie van de verminderde vorm. In de meeste cellulaire omstandigheden is de geoxideerde vorm slechts een zeer kleine fractie van de totale pool, maar nog steeds met fysiologische implicaties.
een verwarrend aspect van redoxreacties is dat de overdracht verschillende vormen kan aannemen. In één geval zijn het alleen elektronen zoals in de reacties die door cytochromen in elektronenoverdrachtketens worden uitgevoerd. In een ander veel voorkomend geval is het een combinatie van elektronen en protonen zoals in de cofactor NAD+/NADH waar twee elektronen en een proton (H+) worden overgedragen. Tenslotte zijn er de reacties waarbij hetzelfde aantal elektronen en protonen wordt overgedragen wanneer men natuurlijk zou worden verleid om de overdracht van waterstof te bespreken. Dit is bijvoorbeeld het geval voor de algehele reactie van glucose oxidatie waarbij zuurstof wordt gereduceerd tot water. Twee waterstofatomen zijn dus overgedragen, dus moet men de overdracht van elektronen, waterstofatomen of protonen bespreken? De definitie van het redoxpotentiaal (hierboven gegeven) richt zich alleen op de elektron “toestand”. Hoe zit het met de protonen en wat gebeurt er met deze wanneer men tegenkomt een keten van elektronenoverdracht reacties waar sommige tussenverbindingen bevatten de waterstof protonen en sommige niet? De verklaring ligt in het omringende water en hun pH. de reactie vindt plaats bij een bepaalde pH, en de reagerende verbindingen zijn in evenwicht met deze pH en dus het afgeven of ontvangen van een proton heeft geen effect op de energetica. Het waterige medium dient als een pool waar protonen kunnen worden “geparkeerd” wanneer de transferreactie uitsluitend van elektronen is (de analogie ontleend aan het zeer toegankelijke inleidende biochemie Boek “the chemistry of life” van Steven Rose). Deze geparkeerde protonen kunnen in volgende stadia worden geleend zoals in de laatste fase van oxidatieve ademhaling gebeurt waar cytochroom oxidase protonen uit het medium neemt. Omdat men ervan uitgaat dat water alomtegenwoordig is hoeft men geen rekening te houden met protonen behalve met het kennen van de heersende pH die de neiging om protonen te geven of te ontvangen weergeeft. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




