overweeg delokalisatie van elektronendichtheid. Dat is wanneer de elektronendichtheid zoveel mogelijk over een molecuul wordt verspreid, zodat de minimale ladingsopbouw in een gegeven orbitaal aanwezig is.
dat wordt beschreven:
- gezamenlijk door alle resonantie-bijdragers in Lewis-structuren.
- gezamenlijk door alle individuele moleculaire orbitale bijdragen in moleculaire orbitale diagrammen.
(Er zijn subtiele verschillen tussen deze, maar deze zijn ruwweg analoog voor eenvoud. Zie hier voor meer details.)
lokalisatie van de elektronendichtheid is het ontbreken daarvan.
Het is wanneer we alle elektronendichtheid in een paar orbitalen proppen, in plaats van het uit te spreiden, en het gebeurt bijna nooit echt in een echt molecuul of kwantumsysteem (zelfs als er geen resonantie aan de gang is).
voorbeeld met resonantiestructuren
beschouw de geïsoleerde (niet-reagerende) allylkation, #”C”_3″H”_5^(+)#.
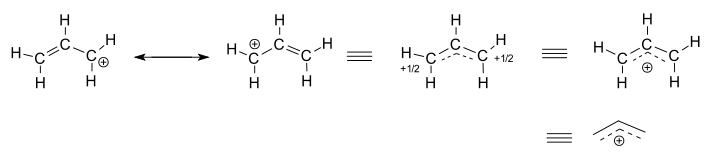
- de linker twee structuren zijn resonantie-bijdragers, die elk gelokaliseerde representaties zijn van de ware delokaliseerde structuur.
- de drie rechts-hand structuren zijn elk representaties van de resonantie hybride structuur, of de gedelokaliseerde structuur.
De gedelokaliseerde structuur wordt in principe beschreven door een verzameling bindingsmoleculaire orbitalen.
voorbeeld met een moleculair orbitaal DIAGRAM
beschouw het allylkation opnieuw in een MO diagram dat alleen de #bbpi# elektronen beschrijft (d.w.z. de elektronen die in een # pi# binding zouden zitten in een gelokaliseerde dubbele binding!), maar maakt deelname aan reacties mogelijk:
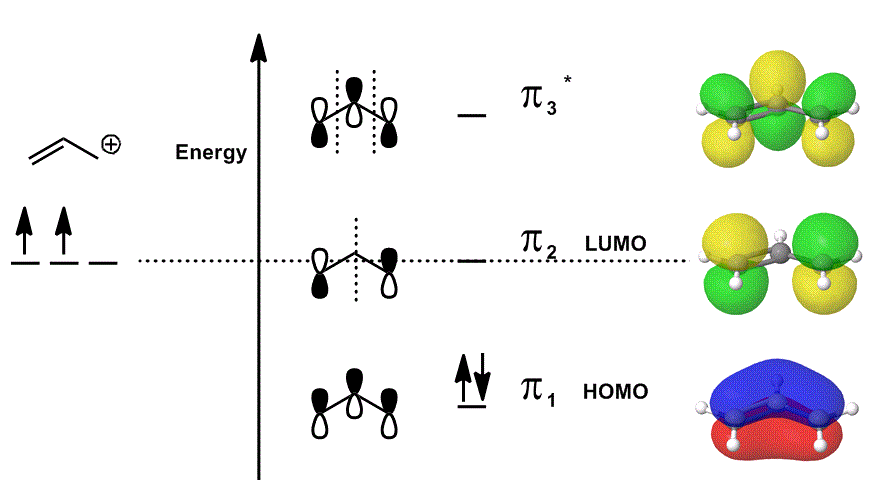
- elk van de orbitale bijdragen in het midden wordt gelokaliseerd weergegeven; de atomaire orbitalen die elkaar zouden overlappen worden als zichzelf (fase inbegrepen) weergegeven.
- alle orbitalen helemaal rechts (één per rij) zijn gedelokaliseerd afgebeeld; de elektronendichtheid wordt toegestaan om zich uit te spreiden zodat de moleculaire orbitalen met volledige overweging van overlappingen, knopen en fasen worden afgebeeld.
wanneer je #pi_1#, #pi_2#, en #pi_3^”*”# overlapt en de gewogen bijdrage van deze toestanden opneemt (gewogen volgens de coëfficiënten # c_i#), krijg je de lineaire combinatie van moleculaire orbitalen:
#Psi_(“allyl”^(+)) = c_1overbrace(pi_1)^”bonding” + c_2overbrace(pi_2)^”nonbonding” + c_3overbrace(pi_3^”*”)^”antibonding”#
en #Psi_(“allyl”^(+))# beschrijft vervolgens de algemene verdeling van toestanden die collectief de reactiviteit van het allylkation beschrijven.
met andere woorden, #pi_1# (die #pi# elektronen doneert aan binding), #pi_2# (die elektronen accepteert aan binding), en #pi_3^”*”# (in dit geval zal het zelden deelnemen) doen allemaal iets wanneer het allylkation deelneemt aan een chemische reactie, omdat ze (indien bezet) tegelijkertijd bestaan.