krzywe grzewcze
rysunek \(\PageIndex{3}\) przedstawia krzywą grzewczą, wykres temperatury w stosunku do czasu nagrzewania dla próbki wody o masie 75 g. Próbka jest początkowo lodem o temperaturze 1 atm i temperaturze -23°C; wraz z dodawaniem ciepła temperatura lodu wzrasta liniowo z czasem. Nachylenie linii zależy zarówno od masy lodu, jak i ciepła właściwego (Cs) lodu, czyli liczby dżuli wymaganych do podniesienia temperatury 1 g lodu o 1°C. Wraz ze wzrostem temperatury lodu cząsteczki wody w krysztale lodu pochłaniają coraz więcej energii i wibrują bardziej energicznie. W temperaturze topnienia mają wystarczającą energię kinetyczną, aby pokonać siły przyciągania i poruszać się względem siebie. W miarę dodawania większej ilości ciepła temperatura układu nie wzrasta dalej, ale pozostaje stała w temperaturze 0°C, dopóki cały lód nie stopi się. Po przekształceniu całego lodu w ciekłą wodę temperatura wody ponownie zaczyna wzrastać. Teraz jednak temperatura wzrasta wolniej niż wcześniej, ponieważ pojemność cieplna wody jest większa niż w przypadku lodu. Gdy temperatura wody osiągnie 100°C, woda zaczyna się gotować. Również tutaj temperatura pozostaje stała na poziomie 100°C, dopóki cała woda nie zostanie przekształcona w parę. W tym momencie Temperatura ponownie zaczyna rosnąć, ale w szybszym tempie niż w innych fazach, ponieważ pojemność cieplna pary jest mniejsza niż w przypadku lodu lub wody.
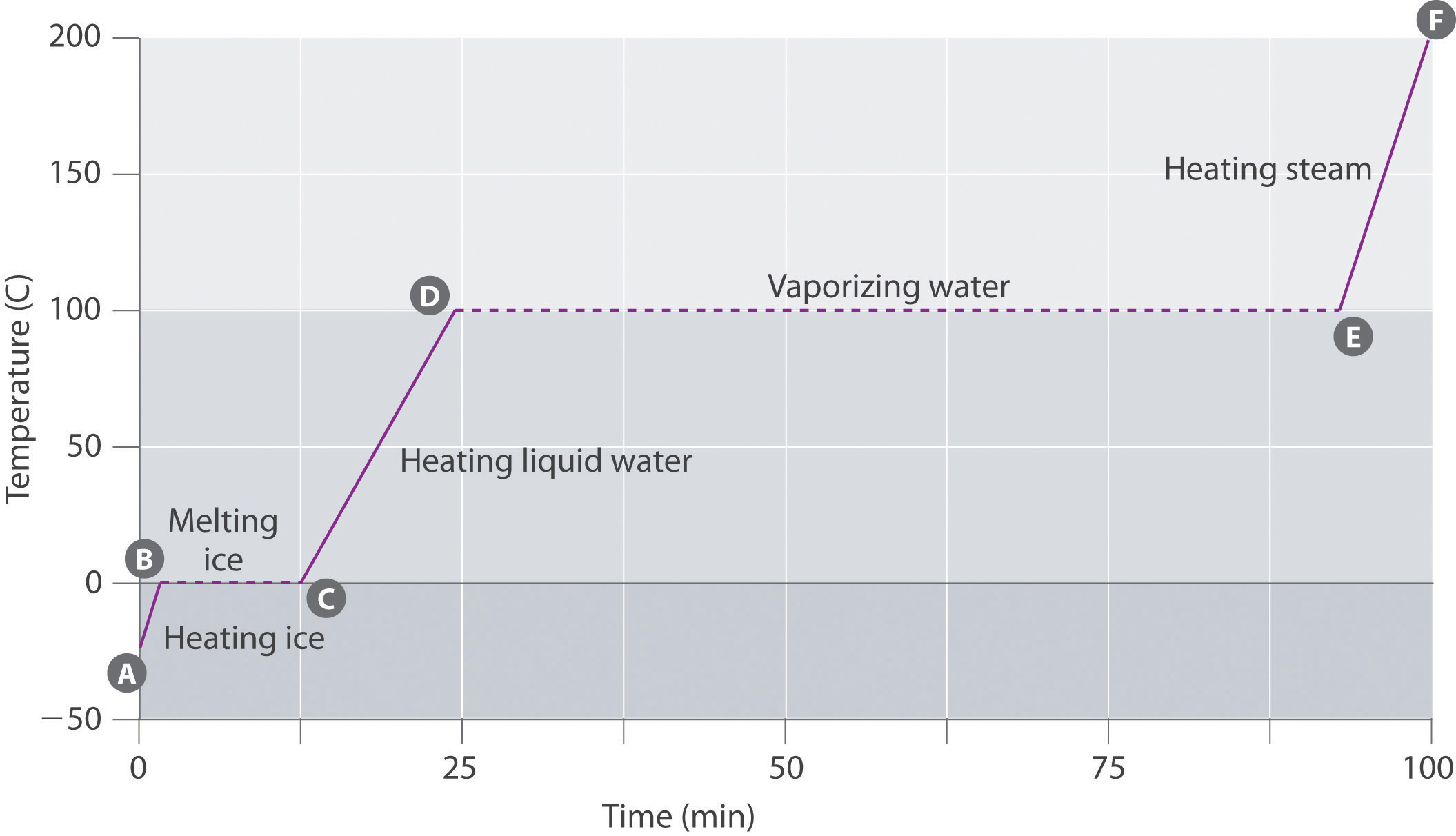
w ten sposób temperatura układu nie zmienia się podczas zmiany fazy. W tym przykładzie, dopóki obecna jest nawet niewielka ilość lodu, temperatura układu pozostaje na poziomie 0°C podczas procesu topienia, a tak długo, jak obecna jest nawet niewielka ilość ciekłej wody, temperatura układu pozostaje na poziomie 100°C podczas procesu wrzenia. Szybkość dodawania ciepła nie wpływa na temperaturę mieszaniny lód / woda lub woda / para, ponieważ dodane ciepło jest wykorzystywane wyłącznie do przezwyciężenia sił przyciągania, które utrzymują bardziej skondensowaną fazę razem. Wielu kucharzy myśleć, że jedzenie będzie gotować szybciej, jeśli ciepło jest włączony wyżej tak, że woda gotuje się szybciej. Zamiast tego garnek z wodą prędzej zagotuje się do sucha, ale temperatura wody nie zależy od tego, jak energicznie się gotuje.
temperatura próbki nie zmienia się podczas zmiany fazy.
Jeśli ciepło jest dodawane ze stałą szybkością, jak na rysunku \(\PageIndex{3}\), to długość linii poziomych, która reprezentuje czas, w którym temperatura nie zmienia się, jest wprost proporcjonalna do wielkości entalpii związanych ze zmianami fazowymi. Na rysunku \(\PageIndex{3}\) pozioma linia w 100°C jest znacznie dłuższa niż linia w 0°C, ponieważ entalpia parowania wody jest kilkakrotnie większa niż entalpia fuzji.
przegrzana ciecz to próbka cieczy w temperaturze i ciśnieniu, przy której powinna być gazem. Przegrzane ciecze nie są stabilne; ciecz ostatecznie zagotuje się, czasami gwałtownie. Zjawisko przegrzania powoduje „bumping”, gdy ciecz jest podgrzewana w laboratorium. Na przykład, gdy probówka zawierająca wodę jest podgrzewana nad palnikiem Bunsena, jedna porcja cieczy może łatwo stać się zbyt gorąca. Gdy przegrzana ciecz przekształca się w gaz, może wypchnąć lub „wypchnąć” resztę cieczy z probówki. Umieszczenie pręta mieszającego lub małego kawałka ceramiki („wrzący chip”) w probówce pozwala na tworzenie się pęcherzyków pary na powierzchni obiektu, aby ciecz gotowała się zamiast ulegać przegrzaniu. Przegrzanie jest powodem, dla którego ciecz ogrzewana w gładkim kubku w kuchence mikrofalowej nie może gotować, dopóki kubek nie zostanie przesunięty,gdy ruch kubka pozwala na tworzenie pęcherzyków.