reakcje redoks polegają na przenoszeniu elektronów z jednej substancji do drugiej, więc warto mieć system do śledzenia, co zyskuje, a co traci elektrony, i ile elektronów jest zaangażowanych. System zapisu dla reakcji redoks nazywa się liczbami utleniania. Możesz też pamiętać coś o nazwie elektroujemność z wcześniejszych lekcji chemii.
elektroujemność
zdolność wiązanego atomu do przyciągania wspólnych elektronów do siebie.
gdy dwa atomy różnych elementów są połączone ze sobą wiązaniem kowalencyjnym (współdzielenie elektronów), elektrony na ogół nie są dzielone równo między dwoma atomami ze względu na różnice w ich elektroujemności. Pomyśl o tym jak o przeciąganiu elektronów. Czasami oba Atomy ciągną się z równą siłą na wspólnych elektronach; innym razem jest wyraźnie silniejszy gracz, który przyciągnie elektrony bliżej siebie.
rozważ wiązanie między atomem wodoru (z jednym elektronem walencyjnym) a atomem tlenu (z sześcioma elektronami walencyjnymi):
|
|
+
|
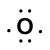 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to atom wodoru. Nie jest to całkowity transfer elektronów, który stworzyłby jon, ale częściowe ładunki tworzą. Wodorowy koniec wiązania jest częściowo dodatni (+1), ponieważ częściowo stracił jeden elektron, a tlenowy koniec H-O jest częściowo ujemny (-1), ponieważ częściowo zyskał jeden elektron z wodoru:
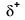 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
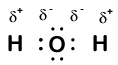
widzimy, że każdy z dwóch atomów wodoru „stracił” jeden elektron na rzecz tlenu. Tlen „zyskał” dwa elektrony—po jednym z każdego wodoru. Ponownie, nie są to prawdziwe jony, ale warto myśleć o nich w ten sam sposób.
ładunki podane atomom w cząsteczce w ten sposób nazywane są liczbami utlenienia. Możemy użyć liczb utleniania, aby śledzić, gdzie elektrony są w cząsteczce i jak poruszają się podczas reakcji. W naszym przykładzie wodorowym wodorowi przypisuje się liczbę utleniania +1, ponieważ każdy pojedynczy Wodór „stracił” jeden elektron. Tlen ma liczbę utleniania +2, ponieważ pojedynczy atom tlenu „zyskał” w sumie dwa elektrony, po jednym z każdego wodoru.
oto inna cząsteczka zawierająca wodór i tlen—nadtlenek wodoru, H2O2:
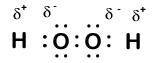
w nadtlenku wodoru każdy Wodór ma liczbę utleniania +1, ponieważ każdy Wodór „oddaje” pojedynczy elektron tlenowi. Tlen ma jednak teraz liczbę utleniania -1, ponieważ każdy tlen zyskuje tylko jeden elektron z sąsiedniego wodoru. Elektrony między dwoma identycznymi atomami tlenu są dzielone równo, więc nie ma ładunku cząstkowego wynikającego z tego wiązania.
Liczba utleniania
dodatnia lub ujemna liczba przypisana atomowi w cząsteczce lub Jonie, która odzwierciedla częściowy przyrost lub utratę elektronów.
znajomość liczby utleniania każdego pojedynczego pierwiastka w cząsteczce będzie kluczowym krokiem w naszym zrozumieniu reakcji redoks. Na szczęście zwykle nie będzie to wiązało się z rysowaniem diagramów kropek elektronów. Zamiast tego, istnieje szereg zasad, których możemy użyć do określenia liczby utleniania. Oto główne zasady:
| liczba utleniania czystego pierwiastka (samego siebie, a nie jonu) wynosi zero. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal do jego podopiecznych. metale alkaliczne-pierwiastki w pierwszej kolumnie układu okresowego – zawsze będą miały liczbę utleniania +1; metale ziem alkalicznych (kolumna 2) są prawie zawsze +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
liczba utleniania tlenu wynosi prawie zawsze -2, gdy znajduje się w związku. wyjątki:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
suma liczb utleniania w związku wynosi zero. aby określić liczbę utleniania Mn w Mn2O7, musimy pracować wstecz:
-2 × 7 atomów = -14 całkowita ponieważ suma liczb utleniania musi wynosić zero, całkowita liczba utleniania Mn musi wynosić +14, aby anulować -14 tlenu, ale ponieważ istnieją 2 atomy mn, każdy pojedynczy atom będzie miał liczbę utleniania +7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
suma liczb utlenienia w Jonie poliatomowym jest równa ładunkowi na tym Jonie. ponownie, pracuj Wstecz, aby określić liczbę utleniania dowolnego atomu bez tlenu lub bez wodoru. aby określić liczbę utleniania Cr w Cr2O72 -:
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is ważne jest, aby pamiętać, że liczba utleniania zawsze odnosi się do każdego pojedynczego atomu w związku, a nie do sumy dla tego pierwiastka.
na przykład w H2O całkowity dodatni „ładunek” dla obu atomów wodoru wyniesie +2 (Co równoważy się z -2 z tlenu), ale każdy Wodór ma liczbę utleniania +1.
Contributions& Atrybucje
ta strona została stworzona z treści za pośrednictwem następujących współpracowników i edytowana (tematycznie lub Szeroko) przez zespół programistów LibreTexts, aby spełnić styl, prezentację i jakość platformy:
-
Fundacja CK-12 Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson i Jean Dupon.