cele uczenia się
- użyj notacji komórkowej do opisu ogniw galwanicznych
- Opisuj podstawowe składniki ogniw galwanicznych\
ogniwa galwaniczne, znane również jako ogniwa fotowoltaiczne, są ogniwami elektrochemicznymi, w których spontaniczne reakcje utleniania-redukcji wytwarzają energię elektryczną. Pisząc równania, często wygodnie jest rozdzielić reakcje utleniania-redukcji na pół-reakcje, aby ułatwić Zrównoważenie ogólnego równania i podkreślić rzeczywiste przemiany chemiczne.
zastanów się, co się dzieje, gdy czysty kawałek metalu miedzi jest umieszczony w roztworze azotanu srebra (rysunek \(\PageIndex{1}\)). Gdy tylko Metal miedzi zostanie dodany, Metal srebra zaczyna się tworzyć, a jony miedzi przechodzą do roztworu. Niebieski kolor roztworu po prawej stronie wskazuje na obecność jonów miedzi. Reakcję można podzielić na dwie pół-reakcje. Pół-reakcje oddzielają utlenianie od redukcji, więc każdą można rozpatrywać indywidualnie.
równanie dla pół-reakcji redukcji musiało zostać podwojone, więc liczba elektronów „zdobytych” w pół-reakcji redukcji była równa liczbie elektronów „utraconych” w pół-reakcji utleniania.

ogniwa galwaniczne lub fotowoltaiczne obejmują spontaniczne reakcje elektrochemiczne, w których pół-reakcje są oddzielone (rysunek \(\PageIndex{2}\)), aby prąd mógł przepływać przez zewnętrzny przewód. Zlewka po lewej stronie figury nazywana jest półkomórką i zawiera 1 M roztwór azotanu miedzi (II) z kawałkiem metalu miedzi częściowo zanurzonego w roztworze. Metal miedzi jest elektrodą. Miedź jest w trakcie utleniania, dlatego elektroda miedziana jest anodą. Anoda jest podłączona do woltomierza za pomocą przewodu, a drugi terminal woltomierza jest podłączony do srebrnej elektrody za pomocą przewodu. Srebro ulega redukcji, dlatego elektroda Srebrna jest katodą. Półkomórka po prawej stronie figury składa się z elektrody srebrnej w 1 M roztworze azotanu srebra (AgNO3). W tym momencie nie płynie prąd—to znaczy nie następuje znaczący ruch elektronów przez przewód, ponieważ obwód jest otwarty. Obwód zamykany jest za pomocą mostu solnego, który przekazuje prąd poruszającymi się jonami. Mostek solny składa się ze stężonego, niereaktywnego roztworu elektrolitu, takiego jak roztwór azotanu sodu (NaNO3) zastosowany w tym przykładzie. Gdy elektrony przepływają od lewej do prawej przez elektrodę i drut, jony azotanowe(aniony) przechodzą przez porowatą wtyczkę po lewej stronie do roztworu azotanu miedzi (II). Utrzymuje to zlewkę po lewej stronie elektrycznie neutralną, neutralizując ładunek na jonach miedzi (II), które są wytwarzane w roztworze, gdy metal miedzi jest utleniany. W tym samym czasie jony azotanowe poruszają się w lewo, jony sodu (kationy) poruszają się w prawo, przez porowatą wtyczkę i do roztworu azotanu srebra po prawej stronie. Te dodane kationy „zastępują” jony srebra, które są usuwane z roztworu, ponieważ zostały zredukowane do metalu srebra, utrzymując zlewkę po prawej stronie elektrycznie neutralną. Bez mostu solnego przedziały nie pozostaną obojętne elektrycznie i żaden znaczący prąd nie popłynie. Jeśli jednak obie komory są w bezpośrednim kontakcie, mostek solny nie jest konieczny. W momencie zakończenia obwodu woltomierz odczytuje + 0,46 V, nazywa się to potencjałem komórkowym. Potencjał komórkowy powstaje, gdy dwa różne metale są połączone i jest miarą energii na jednostkę ładunku dostępnego w reakcji utleniania-redukcji. Volt jest pochodną jednostki SI dla potencjału elektrycznego
\
w tym równaniu, a jest prądem w amperach, A C ładunkiem w kulombach. Należy zauważyć, że wolty muszą być pomnożone przez ładunek w kulombach (C), aby uzyskać energię w dżulach (J).
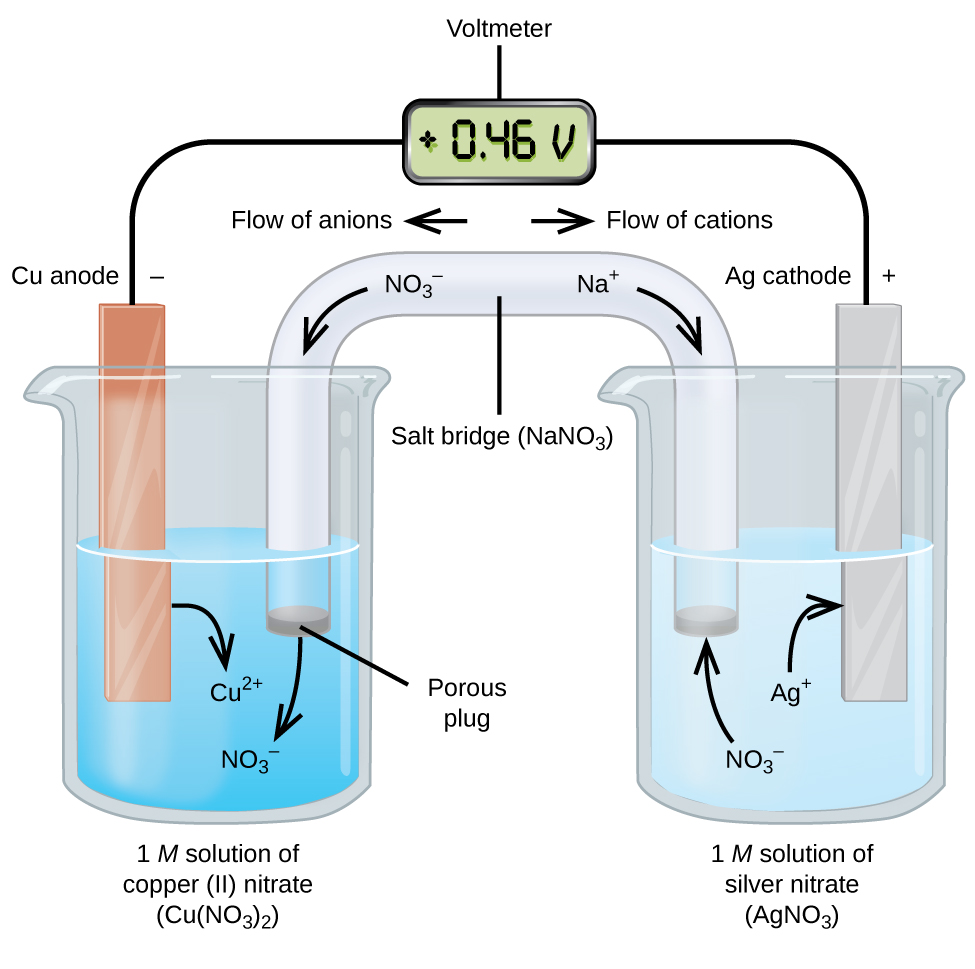
gdy ogniwo elektrochemiczne jest skonstruowane w ten sposób, dodatni potencjał komórkowy wskazuje na spontaniczną reakcję i że elektrony płyną z lewej do prawej. Dużo się dzieje na rysunku \(\PageIndex{2}\), więc warto podsumować rzeczy dla tego systemu:
- elektrony przepływają z anody do katody: od lewej do prawej w standardowej ogniwie galwanicznej na rysunku.
- elektroda w lewej półkomórce jest anodą, ponieważ tutaj zachodzi utlenianie. Nazwa odnosi się do przepływu anionów w kierunku mostu solnego.
- elektroda w prawej półkomórce jest katodą, ponieważ redukcja zachodzi tutaj. Nazwa odnosi się do przepływu kationów w kierunku mostu solnego.
- utlenianie zachodzi na anodzie (lewej półkomórce na rysunku).
- redukcja następuje na katodzie (prawej półkomórce na rysunku).
- potencjał komórkowy, +0,46 V, w tym przypadku, wynika z nieodłącznych różnic w naturze materiałów użytych do wytworzenia dwóch półkomórek.
- mostek solny musi być obecny, aby zamknąć (zakończyć) Obwód i musi nastąpić zarówno utlenianie, jak i redukcja, aby prąd płynął.
istnieje wiele możliwych ogniw galwanicznych, dlatego do ich opisu zwykle używa się skrótu. Notacja komórkowa (czasami nazywana diagramem komórkowym) dostarcza informacji o różnych gatunkach zaangażowanych w reakcję. Zapis ten działa również dla innych typów komórek. Pionowa linia,│, oznacza granicę fazową, a Podwójna Linia,‖, Most solny. Informacja o anodzie jest zapisywana po lewej stronie, następnie roztwór anody, następnie mostek solny (gdy jest obecny), następnie roztwór katody, a na koniec informacja o katodzie po prawej stronie. Zapis komórki dla komórki galwanicznej na rysunku \(\PageIndex{2}\) jest wtedy
\
zauważ, że jony widza nie są uwzględnione i że zastosowano najprostszą formę każdej pół-reakcji. Gdy znane, początkowe stężenia różnych jonów są zwykle zawarte.
jedną z najprostszych komórek jest komórka Daniella. Możliwe jest skonstruowanie tej baterii poprzez umieszczenie miedzianej elektrody na dnie słoika i pokrycie metalu roztworem siarczanu miedzi. Roztwór siarczanu cynku jest unoszony na szczycie roztworu siarczanu miedzi; następnie elektroda cynkowa jest umieszczana w roztworze siarczanu cynku. Podłączenie elektrody miedzianej do elektrody cynkowej umożliwia przepływ prądu elektrycznego. Jest to przykład komórki bez mostu solnego, a jony mogą przepływać przez interfejs między dwoma roztworami.
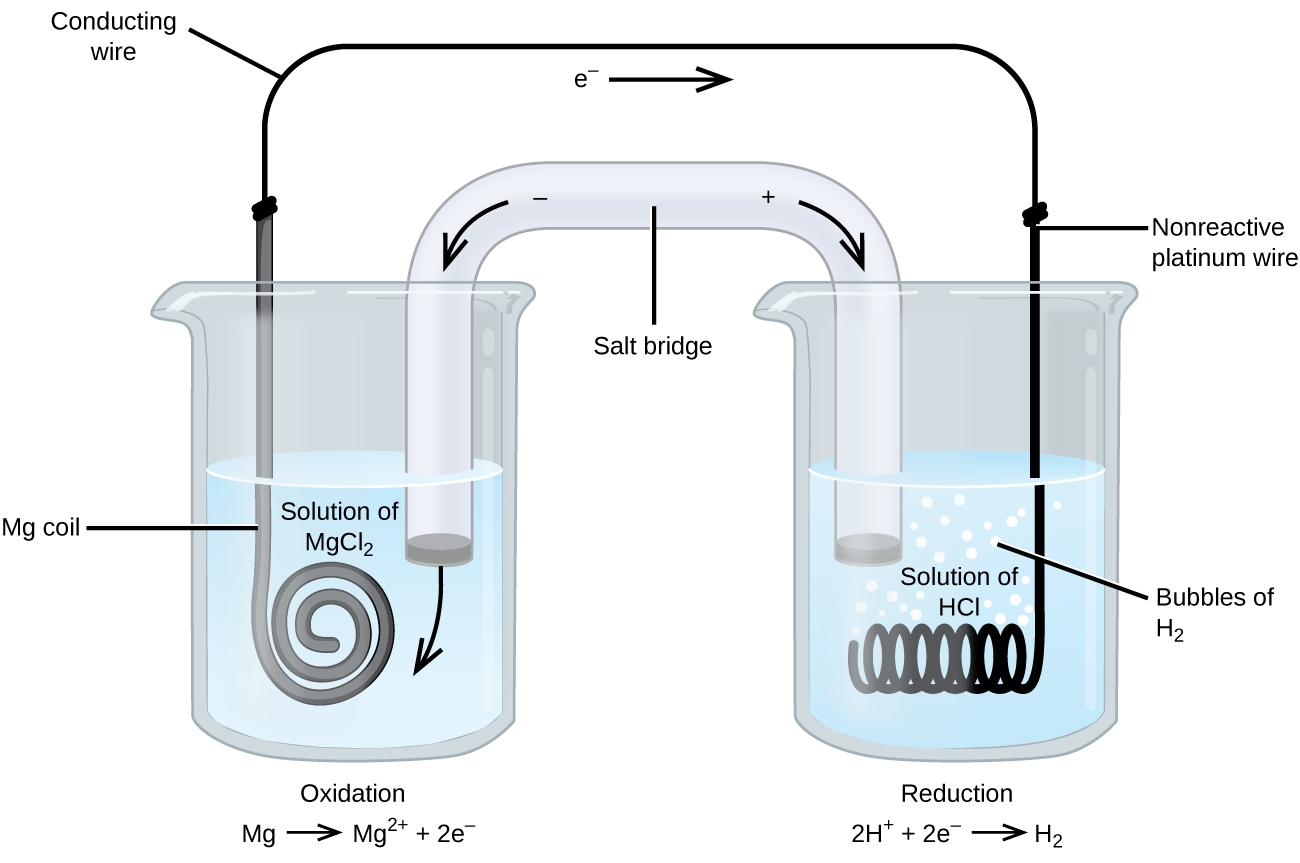
niektóre reakcje utleniania-redukcji dotyczą gatunków, które są słabymi przewodnikami elektryczności, dlatego stosuje się elektrodę, która nie bierze udziału w reakcjach. Często elektrodą jest platyna, złoto lub grafit, z których wszystkie są obojętne na wiele reakcji chemicznych. Jeden z takich systemów jest pokazany na rysunku \(\PageIndex{3}\). Magnez ulega utlenieniu na anodzie po lewej stronie na rysunku, a jony wodorowe ulegają redukcji na katodzie po prawej. Reakcja może być podsumowana jako
komórka wykorzystała obojętny drut platynowy do katody, więc zapis komórki To
elektroda magnezowa jest elektrodą czynną, ponieważ uczestniczy w reakcji utleniania-redukcji. Elektrody obojętne, podobnie jak elektroda Platynowa na rysunku \(\PageIndex{3}\), nie uczestniczą w reakcji utleniania-redukcji i są obecne tak, że prąd może przepływać przez komórkę. Platyna lub złoto na ogół robią dobre elektrody obojętne, ponieważ są chemicznie niereaktywne.
przykład \(\PageIndex{1}\): używając notacji komórek
rozważmy ogniwo galwaniczne składające się z
\
napisz pół-reakcje utleniania i redukcji i zapisz reakcję za pomocą notacji komórek. Jaka reakcja zachodzi na anodzie? Katoda?
rozwiązanie
przez Inspekcję Cr jest utleniany, gdy trzy elektrony są tracone do postaci Cr3+, a Cu2+ jest zmniejszany, ponieważ zyskuje dwa elektrony, tworząc Cu. Równoważenie ładunku daje
\
notacja komórkowa używa najprostszej postaci każdego z równań i zaczyna się od reakcji na anodzie. Nie określono tak stężeń:
\
utlenianie zachodzi na anodzie, a redukcja na katodzie.
przykład \(\PageIndex{2}\): za pomocą notacji komórek
rozważmy komórkę galwaniczną składającą się z
napisz pół-reakcje utleniania i redukcji i zapisz reakcję za pomocą notacji komórek. Jaka reakcja zachodzi na anodzie? Katoda?
roztwór
w wyniku inspekcji Fe2+ ulega utlenianiu, gdy jeden elektron traci formę Fe3+, a MnO4− ulega redukcji, gdy zyskuje pięć elektronów, tworząc Mn2+. Równoważenie ładunku daje
\
notacja komórkowa używa najprostszej postaci każdego z równań i zaczyna się od reakcji na anodzie. Konieczne jest użycie elektrody obojętnej, takiej jak platyna, ponieważ nie ma metalu obecnego do przewodzenia elektronów z anody do katody. Nie określono tak stężeń:
\
utlenianie zachodzi na anodzie, a redukcja na katodzie.
ćwiczenie \(\PageIndex{1}\)
użyj notacji komórkowej do opisu komórki galwanicznej, w której jony miedzi(II) są redukowane do metalu miedzi, a metal cynku jest utleniany do jonów cynku.
odpowiedź
z informacji podanych w problemie:
\
za pomocą notacji komórek:
\
podsumowanie
ogniwa elektrochemiczne zazwyczaj składają się z dwóch półkomórek. Półkomórki oddzielają pół-reakcję utleniania od pół-reakcji redukcji i umożliwiają przepływ prądu przez zewnętrzny przewód. Jedna półkomórka, Zwykle przedstawiona po lewej stronie na rysunku, zawiera anodę. Utlenianie zachodzi na anodzie. Anoda jest połączona z katodą w drugiej połowie ogniwa, często pokazana po prawej stronie na rysunku. Redukcja następuje na katodzie. Dodanie mostu solnego uzupełnia Obwód, umożliwiając przepływ prądu. Aniony w mostku solnym płyną w kierunku anody, a kationy w mostku solnym płyną w kierunku katody. Ruch tych jonów uzupełnia Obwód i utrzymuje każdą półkomórkę elektrycznie neutralną. Komórki elektrochemiczne można opisać za pomocą notacji komórkowej. W zapisie tym informacja o reakcji na anodzie pojawia się po lewej stronie, a informacja o reakcji na katodzie po prawej. Most solny jest reprezentowany przez podwójną linię,‖. Fazy stałe, ciekłe lub wodne w półkomórce są oddzielone pojedynczą linią. Faza i koncentracja poszczególnych gatunków podana jest po nazwie gatunkowej. Elektrody biorące udział w reakcji utleniania-redukcji nazywane są elektrodami aktywnymi. Elektrody, które nie uczestniczą w reakcji utleniania-redukcji, ale są tam, aby umożliwić przepływ prądu, są elektrodami obojętnymi. Elektrody obojętne są często wykonane z platyny lub złota, które pozostają niezmienione przez wiele reakcji chemicznych.
Słowniczek
elektroda aktywna elektroda, która bierze udział w reakcji utleniania-redukcji ogniwa elektrochemicznego; masa elektrody aktywnej zmienia się podczas reakcji utleniania-redukcji elektrody anodowej w ogniwie elektrochemicznym, w którym zachodzi utlenianie; informacja o anodzie jest rejestrowana po lewej stronie mostu solnego w notacji komórkowej elektroda katodowa w ogniwie elektrochemicznym, w którym następuje redukcja; informacja o katodzie jest rejestrowana po prawej stronie mostu solnego w notacji komórkowej notacja komórkowa skrócony sposób reprezentowania reakcji w komórce elektrochemicznej różnica potencjału komórkowego w potencjale elektrycznym, który powstaje, gdy różne metale są połączone; siła napędowa dla przepływu ładunku (prądu) w reakcjach utleniania-redukcji ogniwo galwaniczne ogniwo elektrochemiczne, które obejmuje spontaniczną reakcję utleniania-redukcji; ogniwa elektrochemiczne z dodatnim potencjałem komórkowym; zwane również ogniwem fotowoltaicznym elektroda obojętna elektroda, która umożliwia przepływ prądu, ale która w inny sposób nie uczestniczy w reakcji utleniania-redukcji w ogniwie elektrochemicznym; masa elektrody obojętnej nie zmienia się podczas reakcji utleniania-redukcji; elektrody obojętne są często wykonane z platyny lub złota, ponieważ metale te są chemicznie niereaktywne. ogniwo galwaniczne inna nazwa ogniwa galwanicznego
współtwórcy i Atrybucje
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) i Richard Langley (Stephen F. Austin State University) z współautorami. Zawartość podręczników wyprodukowanych przez OpenStax College jest objęta licencją Creative Commons Attribution License 4.0. Pobierz za darmo na http://cnx.org/contents/85abf193-2bd…[email protected]).