delokalizacja ma miejsce, gdy ładunek elektryczny jest rozłożony na więcej niż jeden atom. Na przykład Wiązanie elektronów może być rozłożone między kilka atomów, które są połączone ze sobą.

przykład 1:
jednym z najbardziej znanych przykładów cząsteczki, w której Wiązanie elektronów jest delokalizowane, jest benzen, pokazany poniżej:
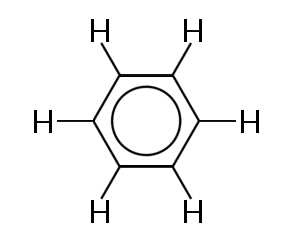
benzen składa się z pierścienia sześciu atomów węgla. Wszystkie atomy węgla są hybrydyzowane sp2 z jednym niehybrydyzowanym orbitalem P.
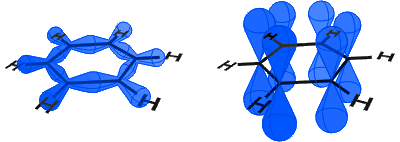
orbitale hybrydowe sp2 wytwarzają normalne wiązania kowalencyjne, czasami nazywane σ-wiązaniami: są to pojedyncze wiązania C-C i pojedyncze wiązania C-H.
To pozostawia każdy węgiel z elektronem w orbitalu p pod kątem prostym do płaszczyzny pierścienia.
na poniższym diagramie, po lewej stronie widać orbitale sp2 tworzące wiązania kowalencyjne. Po prawej widać orbitale p, z których każdy zawiera elektron.
orbitale p łączą się bokiem, a elektrony w orbitalach p są opisane jako π-elektrony.
na poniższym diagramie orbitale p łączą się, a elektrony π są delokalizowane. Przeciętnie wszystkie wiązania pierścieniowe są identyczne.
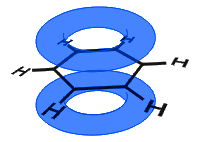
w przeciwieństwie do następnego przykładu poniżej, zdelokalizowane elektrony w benzenie są utrzymywane w cząsteczce i nie mogą swobodnie poruszać się przez materiał sypki.
przykład 2:
metale mają wysoką przewodność cieplną i elektryczną, ponieważ najbardziej zewnętrzne elektrony w ich atomach są delokalizowane. Elektrony te nie są związane z żadnym konkretnym metalicznym jądrem, a więc mogą swobodnie poruszać się po metalu.
podziękowanie: niebieskie zdjęcia orbitali benzenu są dzięki uprzejmości Sansculotte. Te zdjęcia są dostępne na licencji Creative Commons Attribution-Share Alike 1.0 Generic license.