ogniwo fotowoltaiczne, często nazywane ogniwem galwanicznym, dostarcza energii elektrycznej. Źródłem tej energii jest spontaniczna reakcja chemiczna, a dokładniej spontaniczna reakcja redoks.
na przykład wszystkie baterie są wykonane z jednego lub więcej ogniw fotowoltaicznych;baterie stają się płaskie, gdy większość lub wszystkie ich reagenty zostały przekształcone w produkty, przekształcając ich chemiczną energię potencjalną w energię elektryczną.
ogniwa fotowoltaiczne – proces podstawowy
chemiczna energia potencjalna → energia elektryczna
ogniwo fotowoltaiczne jest jednym z dwóch podstawowych typów ogniw elektrochemicznych.Drugi typ to ogniwo elektrolityczne; w ogniwie elektrolitycznym energia elektryczna jest wykorzystywana do napędzania nie spontanicznej reakcji chemicznej.Na przykład wodę można podzielić na wodór i tlen w ogniwie elektrolitycznym. Ponadto, gdy akumulator jest ładowany, działa jako ogniwo elektrolityczne.
podstawowy schemat ogniwa fotowoltaicznego

spontaniczne reakcje redoks na elektrodach wytwarzają napięcie.Prawidłowo skonfigurowane, napięcie to może napędzać elektrony przez urządzenia elektryczne, takie jak Żarówka pokazana here.In na tym diagramie elektrony przenoszą się na anodę, skąd płyną przez żarówkę do katody, gdzie doprowadzają do redukcji.
schemat podstawowego ogniwa elektrolitycznego
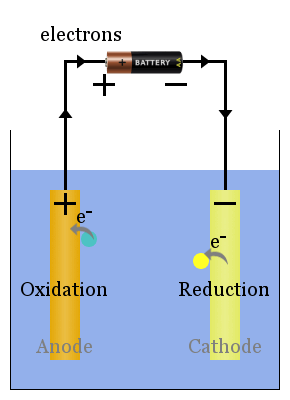
nie spontaniczne reakcje redoks są napędzane przez napięcie zewnętrzne.Procesy ogniwa elektrolitycznego są przeciwieństwem ogniwa fotowoltaicznego. prąd ze źródła zasilania popycha elektrony do katody, gdzie powodują redukcję gatunków.
Czytaj więcej tutaj o katodach i anodach w ogniwach elektrolitycznych.
przykład ogniwa fotowoltaicznego
Bateria Edisona
bateria Edisona to proste, ładowalne ogniwo wymyślone przez Thomasa Edison.It składa się z dwóch metalowych elektrod, jedna wykonana z żelaza, druga z niklu.Podczas początkowego ładowania na elektrodzie niklowej powstaje powłoka tlenku niklu.
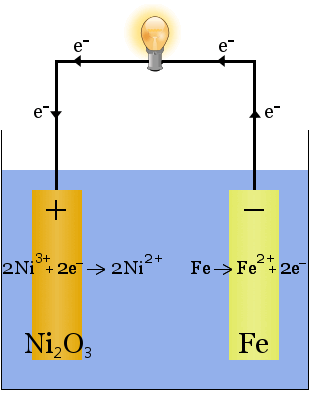
elektrolit (ciecz jonowa między elektrodami) ma 20-30 procent wagowych wodorotlenku potasu w wodzie.Rola wodorotlenku potasu w tym przypadku polega na zwiększeniu przewodności jonowej w celu ukończenia obwodu elektrycznego – wodorotlenek potasu nie jest zużywany w reakcji.
podczas rozładowywania ogniwo Edisona działa jako ogniwo fotowoltaiczne.Gdy jest naładowany, ogniwo działa jako ogniwo elektrolityczne.
równania chemiczne reakcji na elektrodach są:
podczas rozładowania, gdy ogniwo dostarcza energię elektryczną, reakcje powyżej przebiegają w prawo →.
podczas ładowania, gdy ogniwo przetwarza energię elektryczną na chemiczną energię potencjalną, reakcje powyżej przebiegają w lewo.
ogniwo Edisona, z obiema elektrodami dzielącymi ten sam elektrolit, jest jednym z najprostszych ogniw fotowoltaicznych w praktycznym użyciu; większość ogniw fotowoltaicznych jest bardziej skomplikowana.Jego wielkimi zaletami są niezwykła odporność na błędy, takie jak przeładowanie i bardzo długa żywotność, z niemal nieograniczonym cyklem ładowania i rozładowania.
jego największą wadą jest to, że w stosunku do mocy wyjściowej jest bardzo ciężki.
kolejny przykład
Baterie Litowe
postęp w technologii baterii doprowadził do miniaturyzacji urządzeń elektronicznych.Bez tych postępów nowoczesne urządzenia, takie jak telefony komórkowe i Tablety, byłyby większe i bardziej uciążliwe.
sercem tych postępów była technologia litowo-jonowa.Pierwiastek lit jest metalem o bardzo niskiej gęstości: przy 0,534 g / cm3 lit jest w połowie tak gęsty jak woda; lit unosi się na wodzie.Porównaj to z metalami w komórce Edisona, gęstość niklu wynosi 8,908 g / cm3, a żelaza 7,874 g/cm3: są one ponad 10 razy większe niż gęstość litu.
wysoki potencjał redoks litu w połączeniu z niską gęstością sprawia, że jony są idealne do zastosowania jako materiał akumulatorowy.
typowa bateria litowo-jonowa jest oparta na porowatych elektrodach, które umożliwiają jony Li przemieszczanie się i wychodzenie z porów.Na przykład akumulator litowo-jonowy może mieć elektrodę grafitową i elektrodę tlenku kobaltu z domieszką litu z polioksyetylenowym elektrolitem zawierającym sól LiPF6.
gdy taki akumulator zasila urządzenie, Atomy litu znajdujące się w strukturze warstwowej anody grafitowej są utleniane, tworząc jony.
na katodzie jony litu są redukowane w strukturze tlenku kobaltu.
These reactions are reversed when the cell is being charged.
