wprowadzenie
zasoby kopalne są głównym surowcem dla energii i związków organicznych, a ich wykorzystanie skutkuje emisją gazów cieplarnianych związanych ze zmianami klimatu. Nadchodzący krach klimatyczny wymaga pilnego przejścia od gospodarki opartej na kopalnych korzeniach do gospodarki opartej na biomasie, w której do produkcji paliw, chemikaliów i materiałów wykorzystuje się raczej biomasę lignocelulozową niż ropę naftową. Drewno jest ważnym źródłem biomasy lignocelulozowej; składa się głównie z wtórnie zagęszczonych ścian komórkowych bogatych w celulozę, hemicelulozy i ligninę. Wszystkie trzy polimery mogą być waloryzowane w gospodarce opartej na biologii. Celuloza jest źródłem dla przemysłu celulozowo-papierniczego, a zarówno celuloza, jak i hemicelulozy mogą być depolimeryzowane do swoich monosacharydów w celu fermentacji na przykład do bioetanolu, kwasu mlekowego i detergentów (Vanholme et al., 2013b). Ponieważ lignina negatywnie wpływa na wydajność przetwarzania drewna w tych zastosowaniach, drzewa mogą być zaprojektowane tak, aby gromadzić mniej ligniny, aby stać się bardziej podatne na produkcję papieru i cukrów fermentowalnych. Z drugiej strony lignina jest coraz częściej uważana za cenny składnik w gospodarce opartej na biotechnologii. Rzeczywiście, biorąc pod uwagę, że lignina jest największym odnawialnym źródłem aromatycznym na Ziemi, ekonomiczna żywotność bio-rafinerii może być znacznie zwiększona, jeśli lignina jest również waloryzowana i wykorzystywana jako zasób do produkcji chemikaliów (Holladay et al., 2007; Tuck et al., 2012; Davis et al., 2013; Ragauskas et al., 2014; Li C. et al., 2015; Van den Bosch et al., 2015; Rinaldi et al., 2016; Upton and Kasko, 2016; Schutyser et al., 2018).
polimer ligniny składa się z monolignoli, które są wytwarzane przez drogi biosyntetyczne fenylopropanoidu i monolignolu, w wyniku szeregu reakcji enzymatycznych, począwszy od deaminacji fenyloalaniny (Fig.1). Monolignole są syntetyzowane w cytoplazmie i translokowane do apoplastu, gdzie są dehydrogenowane do rodników monolignolowych przez działanie laccases i peroksydaz (Berthet i wsp ., 2011; Zhao et al., 2013). Te rodniki monolignolowe następnie łączą się ze sobą w kombinatoryczny sposób, tworząc szereg wiązań chemicznych, takich jak Wiązanie eteru arylowego (β-O-4), Wiązanie rezinolowe (β-β) i Wiązanie fenylokumaranowe (β-5) (Boerjan i in., 2003; Ralph et al., 2004; Vanholme et al., 2010). Najczęstszymi monolignolami są alkohole hydroksycynamylowe P-kumaryl, coniferyl i sinapyl, które generują jednostki H, G i S po ich włączeniu do polimeru ligniny, odpowiednio (Bonawitz and Chapple, 2010; Ralph et al., 2019; Vanholme et al., 2019). Względny wkład bloków budulcowych ligniny różni się w zależności od taksonów, stadium rozwoju, typu tkanki i komórki, a nawet warstwy ściany komórkowej; lignina z iglastych (gymnosperms) składa się prawie w całości z jednostek G z niewielkim ułamkiem jednostek H, podczas gdy lignina z liściastych (angiosperms) ma jednostki s oprócz jednostek G i ślady jednostek H (Boerjan et al., 2003; Vanholme et al., 2010, 2019). Oprócz tych tradycyjnych monolignoli, wiele innych P-hydroksylowanych cząsteczek aromatycznych może być włączonych do polimeru ligniny na różnych poziomach(Vanholme et al., 2019).
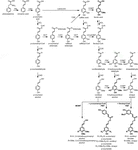
Figure 1. Lignin biosynthetic pathway. Alternative monomers and heterologously expressed enzymes are shown in bold. PAL, phenylalanine ammonia-lyase; C4H, cinnamate 4-hydroxylase; 4CL, 4-coumarate:CoA ligase; HCT, p-Hydroxycinnamoyl-CoA:quinate/shikimate-p-hydroxycinnamoyltransferase; C3’H, p-coumaroyl quinate/shikimate 3’-hydroxylase; CSE, caffeoyl shikimate esterase; CCoAOMT, caffeoyl-CoA O-methyltransferase; CCR, cinnamoyl-CoA reductase; F5H, ferulate 5-hydroxylase/CAld5H, coniferaldehyde 5-hydroxylase; COMT, o-metylotransferaza kwasu kawowego; CAD, dehydrogenaza alkoholu cynamylowego; FMT, transferaza monolignolowa feruloilo-CoA; PMT, transferaza monolignolowa P-kumaroylo-Coa.
biorąc pod uwagę, że lignina jest głównym czynnikiem oporności w procesach delignifikacji drewna, duże wysiłki badawcze zostały poświęcone rozwikłaniu szlaku biosyntezy ligniny oraz zbadaniu wpływu perturbacji genów biosyntezy ligniny na ilość i skład ligniny oraz na wydajność przetwarzania drewna. Podczas gdy zmiany w genach, począwszy od tych kodujących czynniki transkrypcyjne do tych kodujących enzymy oksydacyjne, spowodowały zmianę zawartości ligniny, składu lub odkładania (Eriksson et al., 2000; Li Y. H. et al., 2003; Liang et al., 2008; Lu et al., 2013; Lin et al., 2016; Xu et al., 2017; Yang et al., 2017; Obudulu et al., 2018), Przegląd ten skupi się na wynikach uzyskanych przez inżynierię biosyntetycznych genów ligniny.
Inżynieria Szlaku ligniny
Tabela 1 zawiera przegląd różnych badań nad obniżonymi lub zmutowanymi genami biosyntetycznymi ligniny u topoli, sosny, eukaliptusa i brzozy, z wynikającym z tego wpływem na wydajność przetwarzania drewna, po ustaleniu. Zmniejszenie aktywności dowolnego etapu szlaku biosyntezy ligniny, począwszy od PAL do CAD, może skutkować zmniejszeniem zawartości ligniny(Tabela 1). Na stopień redukcji ligniny wpływa kilka parametrów, takich jak gen docelowy i stopień obniżania aktywności enzymu, co z kolei zależy od wydajności użytej konstrukcji wyciszającej, wielkości rodziny genów i redundancji w obrębie rodziny genów. Ogólnie rzecz biorąc, obniżenie stopni od C4H do CCR powoduje bardziej dramatyczne zmniejszenie ilości ligniny (Hu et al., 1999; Meyermans et al., 2000; Zhong et al., 2000; Li L. et al., 2003; Jia et al., 2004; Lu et al., 2004; Leplé et al., 2007; Coleman et al., 2008a, b; Bjurhager et al., 2010; Mansfield et al., 2012; Ralph et al., 2012; Min et al., 2014; Van Acker et al., 2014; Zhou et al., 2015, 2018; Saleme et al., 2017; Xiang et al., 2017) niż downregulation F5H, COMT i CAD (Van Doorsselaere et al., 1995; Baucher et al., 1996; Lapierre et al., 1999; Jouanin et al., 2000; Van Acker et al., 2014; Wang et al., 2018). Redukcja ligniny może być związana ze wzrostem S / G, np. w C3 ’ H – (Coleman i wsp ., 2008a; Ralph et al., 2012) i CCoAOMT-downregulated trees (Meyermans et al., 2000), lub spadek wskaźnika S/G, taki jak w CSE- (Saleme et al., 2017), oraz drzew powalonych (Van Doorsselaere et al., 1995; Lapierre et al., 1999; Jouanin et al., 2000). Co ciekawe, stwierdzono, że topole o niskiej zawartości ligniny 4CL w dół mają wzrost S / g (Min et al., 2014; Xiang et al., 2017), Spadek S/G (Voelker et al., 2010; Zhou et al., 2015), lub współczynniki porównywalne do typu dzikiego (Hu et al., 1999; Li L. et al., 2003). Ta wariancja nie może być związana z promotorem lub metodą zastosowaną do downregulacji, co sugeruje, że różnice w stopniu wyciszenia, warunkach wzrostu lub stanie rozwojowym wpływają na tę cechę. Z drugiej strony, najsilniejszy wpływ na skład ligniny H / G / s zaobserwowano dla drzew obniżonych w C3 ’ H I HCT, które odkładają ligninę o dużym wzroście zawartości jednostek H (Coleman et al., 2008a; Ralph et al., 2012; Vanholme et al., 2013a), podczas gdy drzewa, które nadekspresują F5H wytwarzają ligninę silnie wzbogaconą w jednostki S (Franke et al., 2000; Li L. et al., 2003; Stewart et al., 2009), a drzewa, które są obniżone w COMT, znacznie zmniejszyły biosyntezę jednostki s (Van Doorsselaere et al., 1995; Lapierre et al., 1999).

Tabela 1. Przegląd drzew leśnych ze zmodyfikowaną ekspresją genów biosyntezy ligniny.
efektywność przetwarzania biomasy można również modyfikować poprzez zwiększone włączenie cząsteczek, które na ogół stanowią drobne składniki w ligninie roślin dzikiego typu. Włączenie kwasu ferulowego w drzewach z niedoborem CCR powoduje tworzenie wiązań acetalowych w polimerze ligniny, które są łatwo rozszczepiane w kwaśnych wstępnych obróbkach biomasy (Leplé et al., 2007; Ralph et al., 2008; Van Acker et al., 2014). Rzeczywiście, poziom kwasu ferulowego w ligninie dodatnio korelował z wyższą wydajnością scukrzania (Van Acker et al., 2014). Włączenie alkoholu 5-hydroksykoniferylowego i aldehydu 5-hydroksykoniferowego do ligniny topoli z niedoborem COMT (Van Doorsselaere et al., 1995; Lapierre et al., 1999; Jouanin et al., 2000; Morreel et al., 2004; Lu et al., 2010) powoduje powstanie wiązań benzodioksanowych, potencjalnie zapobiegając wiązaniom kowalencyjnym między ligniną a grupami hydroksylowymi polisacharydów (Weng i in., 2010; Vanholme et al., 2012; Nishimura et al., 2018). Z drugiej strony, niedobór COMT powoduje również bardziej skondensowaną ligninę ze względu na stosunkowo wyższe poziomy skondensowanych wiązań β-β i β-5 oraz niższe poziomy wiązań β-O-4, gdy częstotliwość jednostki s spada. Chemiczne roztwarzanie drewna pochodzącego z topoli silnie obniżonych dla COMT spowodowało wyższą wydajność pulpy, równoważoną przez resztkową zawartość ligniny w pulpie. Drzewa te miały niższą ligninę i wyższą zawartość celulozy (Jouanin et al., 2000). Z drugiej strony, topole, które były umiarkowanie obniżone dla COMT, miały duży spadek wydajności pulpy, prawdopodobnie dlatego, że zawartość ligniny pozostała normalna, podczas gdy lignina miała większą częstotliwość skondensowanych wiązań, które negatywnie wpływały na ekstrakcję ligniny(Lapierre et al., 1999; Piłat et al., 2002). Włączenie cynamonaldehydów do polimeru ligniny w drzewach z niedoborem CAD powoduje krótsze łańcuchy polimeru ligniny, a zatem wyższy odsetek wolnych fenolowych grup końcowych, które zwiększają rozpuszczalność polimeru w alkaliach. Włączenie cynamonaldehydów do polimeru ligniny prawdopodobnie zmniejsza również kowalencyjne oddziaływanie łańcucha alifatycznego z hemicelulozą, ponownie czyniąc ligninę bardziej rozpuszczalną. Ponadto, ze względu na Rozszerzony układ sprzężony, który powstaje, gdy β-O-4 aldehydu cynamonowego łączy się z innym monomerem, aromatyczne Wiązanie eterowe włączonego aldehydu cynamonowego staje się bardziej podatne na rozszczepianie zasadowe (Lapierre i in., 1989; Van Acker et al., 2017).
polimeryzacja ligniny jest kombinatorycznym procesem sprzęgania rodników, umożliwiającym naturalne włączenie szerokiej gamy związków fenolowych do polimeru ligniny (Boerjan et al., 2003; Vanholme et al., 2019). Naukowcy próbowali dostosować ilość i skład ligniny w celu poprawy przetwarzania biomasy przez ekspresję heterologicznych genów, dążąc do biosyntezy i włączenia różnych kompatybilnych związków fenolowych jako alternatywnych monolignoli do polimeru ligniny(Ralph, 2006; Vanholme et al., 2012; Mottiar et al., 2016; Mahon and Mansfield, 2018). Jednym z przykładów jest wprowadzenie genów kodujących enzymy, które są potrzebne do biosyntezy jednostek s w sosnie; jednoczesna ekspresja f5h, COMT i CAD skutecznie wprowadziła jednostki s W Pinus radiata (Wagner et al., 2015; Edmunds et al., 2017). Wprowadzenie genu kodującego 4-o-metylotransferazę MONOLIGNOLOWĄ (MOMT4) do topoli prowadzi do powstania 4-o-metylowanych alkoholi iglastych i sinapylowych, których nie można włączyć do rosnącego polimeru ligniny, ponieważ brakuje im aromatycznej grupy hydroksylowej. Prowadzi to do zatrzymania polimeryzacji ligniny i skutkuje drzewami o niższej zawartości ligniny i wyższej wydajności scukrzania (Bhuiya and Liu, 2010; CAI et al., 2016). Topole zostały również zaprojektowane tak, aby zawierały wiązania estrowe w szkielecie polimeru ligniny. Estry ferulatu koniferylu wprowadzono do polimeru poprzez ekspresję genu transferazy FERULOIL-COA: MONOLIGNOL (FMT) pochodzącego z Angelica sinensis (Wilkerson et al., 2014), co prowadzi do poprawy efektywności scukrzania w różnych warunkach obróbki wstępnej (Wilkerson et al., 2014; Kim et al., 2017; Bhalla et al., 2018) i ulepszona wydajność roztwarzania kraft w porównaniu do typu dzikiego (Zhou et al., 2017). Estry P-kumarynianu monolignolu zostały również zaprojektowane w Topoli, poprzez ekspresję genu transferazy monolignolowej (PMT) ryżu P-KUMAROILO-CoA, co skutkuje wyższą częstotliwością opornych wiązań międzycząsteczkowych i wyższą częstotliwością jednostek końcowych G I S z wolnymi grupami fenolowymi(Smith i in., 2015; Sibout et al., 2016). Podczas gdy u Arabidopsis heterologiczna ekspresja PMT powodowała zmniejszenie ilości ligniny wraz ze zwiększoną wydajnością scukrzania (Sibout et al., 2016), nie stwierdzono zmniejszenia ilości ligniny w topoli i nie określono skuteczności scukrzania (Smith et al., 2015).
podczas gdy wykazano, że kilka modyfikacji ilości i składu ligniny zapewnia poprawę w przetwarzaniu biomasy, modyfikacjom tym często towarzyszyła kara za wydajność biomasy (Leplé et al., 2007; Wadenbäck et al., 2008; Wagner et al., 2009; Voelker et al., 2010; Stout et al., 2014; Van Acker et al., 2014; Sykes et al., 2015; Zhou et al., 2018). Niedawne przerzuty zaburzyły 21 genów biosyntezy ligniny w P. trichocarpa i kompleksowo zintegrował wyniki transkryptomicznych, proteomicznych, fluxomicznych i fenomenalnych danych 221 linii. Autorzy doszli do wniosku, że wzrost drzew nie jest związany z ilością ligniny, składem podjednostek ani specyficznymi powiązaniami (Wang et al., 2018), ale raczej skorelowane z obecnością zawalonych naczyń ksylemowych (Coleman et al., 2008a, B; Wagner et al., 2009; Voelker et al., 2010; Vargas et al., 2016; De Meester et al., 2018), aktywacja szlaku integralności ściany komórkowej (Bonawitz et al., 2014) i/lub nagromadzenie inhibitorów chemicznych (Gallego-Giraldo et al., 2011; Muro-Villanueva et al., 2019).
podczas gdy znaczne wysiłki zostały podjęte w celu zmniejszenia zawartości ligniny poprzez obniżenie regulacji genów biosyntetycznych ligniny, badania nad zwiększeniem szlaku ligniny i nadprodukcją ligniny były ograniczone. Rzeczywiście, raporty na temat nadekspresji F5H wykazują niezmienioną lub nawet spadek zawartości ligniny(Huntley et al., 2003; Li L. et al., 2003; Stewart et al., 2009; Mansfield et al., 2012; Edmunds et al., 2017). Nadekspresja CAD i COMT spowodowała wyciszenie genów, a nie upregulację, lub nie wykryto wpływu na poziomy ekspresji (Baucher et al., 1996; Lapierre et al., 1999; Jouanin et al., 2000; Leplé et al., 2007; Van Acker et al., 2014). Nadekspresja czynników transkrypcyjnych R2r3-MYB PtoMYB92, PtoMYB216 i PtoMYB74 spowodowała dodatkowe warstwy ksylemu, grubsze ściany komórkowe ksylemu, a także pozamaciczne odkładanie ligniny, a rośliny zgromadziły 13-50% więcej ligniny (Tian Q. et al., 2013; Li C. F. et al., 2015; Li et al., 2018). Linie nadekspresji MYB konstytutywnie zwiększały geny szlaku biosyntezy ligniny i podczas gdy rośliny nadekspresujące MYB92 i MYB74 miały karę za biomasę, nadekspresja MYB216 powodowała, że rośliny miały do 50% więcej ligniny i nie miały fenotypu rozwojowego. Ponieważ lignina jest coraz częściej uważana za ważny zasób zrównoważonej produkcji chemikaliów (Cao et al., 2018) należy dalej badać inżynierię zakładów nadprodukujących ligninę.
badania terenowe
przykłady omówione powyżej wyraźnie pokazują, że inżynieria ligniny poprzez regulację w dół lub w górę genów szlaku fenylopropanoidowego – lub ekspresję genów heterologicznych – ma potencjał do zwiększenia wydajności przetwarzania biomasy lignocelulozowej. Ze względów praktycznych i regulacyjnych większość badań przedstawia dane uzyskane z analizy drzew uprawianych w szklarni. Jednak eksperymenty z drzewami uprawianymi w szklarni zazwyczaj nie uwzględniają procesów rozwojowych, takich jak wstrzymanie wzrostu i uśpienie. Ponadto eksperymenty szklarniowe nie zapewniają wystarczającego wglądu w interakcję zaprojektowanej rośliny z czynnikami środowiskowymi, takimi jak rodzaj gleby, wiatr i patogeny. Zrozumienie tych interakcji jest ważnym krokiem w przekładaniu wyników badań na zastosowania komercyjne. W istocie, zbiór prac wykonanych w ramach badań, dla których wydano pozwolenie na prowadzenie badań terenowych, podkreśla istotne różnice w fenotypie między drzewami szklarniowymi i polowymi. Tabela 1 podsumowuje raporty z badań terenowych przeprowadzonych z drzewami 4CL, CCoAOMT, CCR, COMT i CAD downregulated.
potwierdzając potencjał zmodyfikowanej biomasy lignocelulozowej jako substratu do zastosowań, kilka drzew wyhodowanych w Warunkach próbnych z ligniną wykazało poprawę w przetwarzaniu drewna. Topole obniżone dla ccoaomt uprawianych przez 5 lat w próbie terenowej w Pekinie (Chiny), wykazały zwiększone uwalnianie glukozy i ksylozy po scukrzaniu (Wang et al., 2012). Topole obniżone do CCR i uprawiane w próbach polowych we Francji okazały się bardziej podatne na chemiczne roztwarzanie kraft (Leplé et al., 2007). Dwie dodatkowe próby terenowe przeprowadzone we Francji i Belgii z Topolami regulowanymi CCR-down spowodowały do 160% poprawę produkcji etanolu w testach jednoczesnego scukrzania i fermentacji (SSF); jednak rośliny miały do 50% redukcję biomasy (Van Acker et al., 2014). Próby terenowe z topolą regulowaną CAD-down również wykazały obiecujące wyniki. Drzewa te wykazywały nieco mniej ligniny niż typ dziki i okazały się bardziej podatne na delignifikację kraft(Lapierre et al., 1999). Konsekwentnie, te same linie uprawiane w badaniach polowych na większą skalę we Francji i Zjednoczonym Królestwie wykazały niewielki spadek ilości ligniny i poprawę roztwarzania kraft uznanego za istotne z handlowego punktu widzenia, ponieważ rośliny potrzebowały 6% mniej alkaliów, aby osiągnąć delignifikację podobną do tej W przypadku drzew typu dzikiego (Piłate et al., 2002).
jednak sprzeczne raporty dotyczące zarówno wydajności biomasy, jak i wydajności przetwarzania końcowego sugerują, że czynniki środowiskowe w dużym stopniu wpływają na te parametry. Podczas badania terenowego przeprowadzonego w Chinach przy użyciu topoli 4CL downregulated okazało się, że nawet przy 28% spadku zawartości ligniny w porównaniu do typu dzikiego, drzewa miały około 8% zwiększoną wysokość (Tian X. M. et al., 2013), zgodne z badaniami szklarni (Hu et al., 1999), inne badania terenowe wykazały, że 4CL-downregulated topole zmniejszyły biomasę, a czasami były nawet karłowate (Voelker et al., 2010; Stout et al., 2014; Marcin i in., 2017). Raporty różnią się również w odniesieniu do wydajności przetwarzania końcowego drewna pochodzącego z tych 4CL-downregulated polowych uprawianych topoli. Podczas gdy do 100% wzrost odzysku cukru stwierdzono dla drzew 4cl1-downregulated (35S-driven antisense 4CL construct) uprawianych w miejscu górskim w Stanach Zjednoczonych (Xiang et al., 2017), dane uzyskane z badań terenowych przeprowadzonych w Oregonie (Stany Zjednoczone) wykazały, że antysensowne topole 4cl1 napędzane promotorem Pt4CL1 nie miały poprawy wydajności scukrzania w porównaniu do typu dzikiego (Voelker et al., 2010). Podobnie, długoterminowe badanie w Wenling (Chiny) wykazało, że topole o obniżonej wartości 4CL nie wykazały znaczącej poprawy wydajności cukru w porównaniu do typu dzikiego (Wang et al., 2012). W obu tych przypadkach drzewa wykazywały niewielki spadek ilości ligniny, co nie przekładało się na wyższą wydajność przetwarzania, potencjalnie ze względu na wyższe stężenie substancji ekstrahujących, które mogłyby zakłócać aktywność enzymatyczną (Voelker et al., 2010).
badania terenowe wykazały, że czynniki środowiskowe mogą wpływać na lignifikację i przywracać cechy dzikiego typu w porównaniu z poziomami osiągniętymi, gdy te same rośliny były uprawiane w szklarni. Podczas gdy drzewa 4CL-downregulated zmniejszyły zawartość ligniny podczas uprawy w warunkach szklarniowych, analiza tych samych antysensownych topoli 4CL, ale uprawianych w polu, często wykazała, że zawartość ligniny została zwiększona w porównaniu do drzew szklarniowych, a czasami nawet przywrócona do poziomu dzikiego typu(Stout et al., 2014; Xiang et al., 2017). Podobnie poziom ligniny był znacznie mniej obniżony u topoli z niedoborem CCR, gdy były uprawiane w polu, w porównaniu do tego, gdy były uprawiane w szklarni (Van Acker et al., 2014). Co najmniej w przypadku topoli z niedoborem CCR możliwe jest, że wyższy poziom lignifikacji drzew polowych wynika z faktu, że próbki drewna pobierano w okresie zimowym. Gdy wzrost drzew ustaje jesienią, drzewa mają jeszcze czas na pełne zdrewnienie ścian komórkowych, zanim drzewo wejdzie w stan spoczynku, w porównaniu do drzew rosnących w szklarniach, które stale rozwijają nowy ksylem. Wykazano również, że skład ligniny różni się między drzewami o niskiej ligninie uprawianymi w szklarniach i na polu. 4CL-topole w dół uprawiane na polu w Karolinie Północnej miały ligninę o niższym S / G niż gdy te same linie były uprawiane w szklarni(Stout et al., 2014).
łącznie wyniki te pokazują, że dane uzyskane z drzew uprawianych w szklarniach nie mogą być łatwo ekstrapolowane na drzewa uprawiane w terenie, co uzasadnia potrzebę eksperymentów polowych w różnych miejscach. Niektóre linie przedstawiały karę plonu, co czyni je mniej interesującymi dla zastosowań, podkreślając potrzebę lepszego zrozumienia molekularnych podstaw kary plonu i opracowania strategii przezwyciężenia tego problemu.
lignina odgrywa ważną rolę w oporności na patogeny (Miedes et al., 2014; Zhao and Dixon, 2014) i odgrywa kluczową rolę w umożliwieniu roślinie transportu wody. Sugeruje to, że modyfikacje ligniny mogą mieć wpływ na odporność roślin na stres. Podczas gdy dalsze badania są potrzebne, aby w pełni rozwiązać tę możliwość, downregulation 4CL, COMT i CAD w topoli nie dramatycznie zmienić wydajność karmienia liści roślinożerców karmiących (Tiimonen et al., 2005; Brodeur-Campbell et al., 2006; Hjalten et al., 2013). Wpływ downregulation COMT i CAD u Topoli na interakcje roślina-owad został również oceniony na drzewach uprawianych w terenie i wykazano, że drzewa modyfikowane ligniną miały normalną częstość odwiedzania i karmienia owadów ,a także normalną reakcję na drobnoustrojowe patogeny(Piłat et al., 2002; Halpin i in., 2007). Wyniki te wskazują, że drzewa ze zmodyfikowaną ligniną niekoniecznie cierpią bardziej niż dzikie rośliny z powodu szkodników i chorób. Niemniej jednak, profilowanie mikrobiomu bakteryjnego endosfery drewna zebranego z uprawianych w terenie, topolowych regulowanych CCR wykazało zmiany w społeczności bakteryjnej, prawdopodobnie z powodu zmienionej obfitości poszczególnych metabolitów fenolowych w ksylemie(Beckers et al., 2017).
biorąc pod uwagę rolę ligniny w funkcji i strukturze ksylemu, oceniono stosunki wodne kilku topoli o niskiej zawartości ligniny. 4CL-downregulated topole stwierdzono, że mają zmniejszoną przewodność hydrauliczną, potencjalnie zakłócając wzrost roślin(Marchin et al., 2017). Eksperymenty naprężeń hydraulicznych z topoli w dół regulowane dla CCR, COMT lub CAD wykazały, że rośliny te miały mniejszą odporność na kawitację, przy zachowaniu normalnej przewodności hydraulicznej xylem i transportu wody (Awad et al., 2012). Wyniki te sugerują, że na wzrost mutantów o niskiej zawartości ligniny może mieć wpływ dostępność wody. Podobnie jak w przypadku każdej nowej hybrydy uzyskanej z klasycznej hodowli, konieczne są testy terenowe w celu oceny wydajności pola i odporności na stres drzew modyfikowanych ligniną.
perspektywy inżynierii ligniny w drzewach leśnych
wydajnoĹ „Ä ‡ zakĹ’ adĂłw wykorzystujÄ … cych ligninä ™ wydaje siÄ ™ byÄ ‡ pod duĹźym wpĹ 'ywem warunkĂłw Ĺ” rodowiskowych. Nie jest jednak jasne, czy różnice zaobserwowane między drzewami szklarniowymi i polowymi lub między drzewami uprawianymi w różnych lokalizacjach polowych wynikają z różnych poziomów supresji genów lub interakcji zaprojektowanej cechy ze środowiskiem (GxE). Rzeczywiście, niestabilny downregulation jest wadą technik wyciszania genów, które są oparte na RNAi. Jest to świadkami obserwując zmienność w czerwonym fenotypie ksylemu, który jest obserwowany, gdy poszczególne geny biosyntezy ligniny, takie jak CAD, COMT lub CCR, są downregulated. Czerwone zabarwienie ksylemu często nie jest jednolite w całym ksylemie, ale raczej pojawia się w plastrach, które odzwierciedlają zmienne poziomy wyciszania genów (Leplé et al., 2007; Voelker et al., 2010; Van Acker et al., 2014; Rys. 2). Ponadto zastosowanie metod wyciszania genów może potencjalnie prowadzić do jednoczesnego wyciszania blisko spokrewnionych członków rodziny genów-być może w różnym stopniu-przyćmiając interpretacje i maskując skutki downregulacji poszczególnych genów.

Rysunek 2. Patchy Gene downregulation by RNAi. Patchy Red Xylem fenotyp obserwowany na pniach topoli z niedoborem CCR (z prawej) uprawianych w próbie polowej w Belgii. Czerwony ksylem wskazuje obszary obniżonej regulacji CCR. Drewno z drzew typu dzikiego jest białawe (lewe).
problemy te można teraz łatwo przezwyciężyć dzięki zastosowaniu technologii edycji genów opartych na CRISPR, które umożliwiają stabilne mutacje utraty funkcji (knock-out) w określonych genach docelowych, umożliwiając rozwarstwienie funkcji poszczególnych genów w rodzinach. Na przykład, celowanie poszczególnych członków rodziny genów 4CL w Topoli wykazało, że 4CL1 jest związane z lignifikacją, podczas gdy 4CL2 jest zaangażowany w produkcję proantocyjanidyny(Zhou et al., 2015). Oprócz alleli nokautujących, edycja genów oparta na CRISPR pozwala również na tworzenie nowych alleli, które powodują częściową redukcję aktywności enzymu. Otwiera to możliwość precyzyjnego dostrojenia poziomu aktywności enzymów resztkowych i ominięcia kary za plon, która jest często obserwowana, gdy ilość ligniny spada poniżej poziomu progowego. Inną obiecującą drogą do inżynierii ligniny w drzewach leśnych umożliwioną dzięki inżynierii genomu opartej na CRISPR jest jednoczesna Edycja wielu genów (układanie alleli) w celu optymalizacji wydajności przetwarzania biomasy, jak na przykładzie Arabidopsis, gdzie układanie transaldolazy (tra) i mutacji comt, mutacji C4H i comt lub mutacji 4CL i comt spowodowało addytywną i synergiczną poprawę wydajności scukrzania (de Vries et al., 2018). Rzeczywiście, podejście systemowe w P. trichocarpa przewiduje, że jednoczesne obniżenie regulacji PAL i CCoAOMT lub PAL, C3 ’ H I CCOAOMT znacznie poprawi właściwości drewna i uwalnianie cukru(Wang et al., 2018).
zastosowanie edycji genomu opartej na CRISPR w ulepszaniu drzew dla przemysłu celulozowo-papierniczego i bio-rafineryjnego, a także do produkcji aromatów platformowych z hydrogenolitycznego rozkładu ligniny, będzie najcenniejsze, gdy technologia ta zostanie strategicznie połączona z innymi technikami hodowli (ryc. 3). Rzeczywiście, duże zróżnicowanie ilości ligniny i składu S/G już istnieje w naturalnych populacjach drzew leśnych (Studer et al., 2011). Biorąc pod uwagę, że obie cechy wpływają na uwalnianie glukozy po scukrzaniu (Yoo et al., 2018), wykorzystując tę różnorodność genetyczną przez konwencjonalną hodowlę, wspomaganą przez badania szerokiego Stowarzyszenia genomu (GWAS) (Porth et al., 2013; Fahrenkrog et al., 2017; Liu et al., 2018), Hodowla z rzadkimi wadliwymi allelami (Brda) (Vanholme et al., 2013a) lub wybór genomowy (Yin et al., 2010; Muchero et al., 2015; Pawar et al., 2018; Xie et al., 2018), jest cenną strategią pozyskiwania linii, które poprawiły wydajność obróbki drewna. Gdy elitarne drzewa zostaną uzyskane za pomocą tych metod hodowlanych, inżynieria genetyczna i edycja genów oparta na CRISPR jest bardzo obiecującą drogą do dalszej poprawy tych elitarnych genotypów bez łamania ich konstytucji genetycznej i bez przechodzenia przez długie cykle hodowlane. Biorąc pod uwagę zbliżającą się katastrofę klimatyczną, nie mamy więcej czasu do stracenia na przyjęcie tych nowych technik hodowli w naszym wyścigu do gospodarki opartej na technologiach biologicznych.
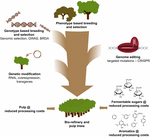
Rysunek 3. Poprawa genetyczna drzew leśnych poprzez połączenie narzędzi hodowlanych. Aby przyspieszyć Ulepszanie genetyczne drzew leśnych na potrzeby pulpy i biorafinerii, należy inteligentnie połączyć klasyczne i nowe narzędzia hodowlane. Klasyczna hodowla polega na fenotypowej selekcji drzew do kontrolowanych krzyżówek, a następnie selekcji fenotypowej. Wraz z pojawieniem się informacji o sekwencji genomu wielu drzew leśnych, opracowano nowe strategie, takie jak selekcja genomu, badania genomu szerokiego skojarzenia (GWAS) i hodowla z rzadkimi wadliwymi allelami (BRDA), aby przyspieszyć wychwytywanie i wzbogacanie polimorfizmów DNA związanych z korzystnymi cechami. Edycja genomu oparta na CRISPR pozwala modyfikować Genom w sposób naśladujący naturalne polimorfizmy. Modyfikacja genetyczna polega na stabilnej integracji obcego DNA z drzewem w celu nadmiernej produkcji (enzym (s) lub zmniejszenia (a) genu(s). Połączenie klasycznych i nowych technik hodowlanych jest konieczne, aby zapewnić społeczeństwu wystarczająco wysokiej jakości drewno.
wkład autora
wszyscy wymienieni autorzy wnieśli znaczący, bezpośredni i intelektualny wkład w pracę i zatwierdzili ją do publikacji.
finansowanie
potwierdzamy częściowe dofinansowanie z projektu BIOLEUM IWT-SBO (dotacja nr 130039) oraz przez SBO-FISH poprzez projekt ARBOREF. AC otrzymała dofinansowanie z FWO oraz unijnego Programu Badań Naukowych i innowacji Horyzont 2020 w ramach umowy o Grant Marie Skłodowska-Curie nr 665501. LdV została sfinansowana przez Instytut Promocji innowacji poprzez naukę i technologię we Flandrii (IWT-Vlaanderen) na stypendium predoctoral fellowship.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
dziękujemy Annick Bleys za przygotowanie artykułu do nadesłania.
Boerjan, W., Ralph, J., and Baucher, M. (2003). Biosynteza ligniny. Annu. Rev. Plant Biol. 54, 519–546.
PubMed Abstract/Google Scholar
Lapierre, C., Pollet, B., Petit-Conil, M., Toval, G., Romero, J., Piłat, G., et al. (1999). Zmiany strukturalne lignin w topolach transgenicznych z obniżoną aktywnością dehydrogenazy alkoholu cynamonowego lub O-metylotransferazy kwasu kawowego mają odwrotny wpływ na wydajność przemysłowego roztwarzania kraft. Plant Physiol. 119, 153–163.
PubMed Abstrakt | Google Scholar
„Co sprawia, że dobry zamiennik monolignol?, „in the Science and Lore of the Plant Cell Wall-Biosynthesis, Structure and Function, ed. T. Hayashi (Boca Raton, FL: BrownWalker Press).
Google Scholar