U. S. Pharm. 2008; 33(4) (Oncology suppl): 20-30.
ABSTRACT: u około 75% kobiet po menopauzie z rakiem piersi występuje choroba z receptorami hormonalnymi (HR+).1 tamoksyfen był standardem leczenia raka piersi HR+ u kobiet po menopauzie aż do pojawienia się selektywnych inhibitorów aromatazy trzeciej generacji, którymi są anastrozol, letrozol i eksemestan.3,4 leki te wykazały lepsze przeżycie wolne od choroby w badaniach klinicznych w porównaniu z tamoksyfenem,ale nie ustalono korzyści z ich stosowania przez ponad pięć lat u kobiet po menopauzie z HR+ rakiem piersi.3,4
szacuje się, że u trzech czwartych kobiet po menopauzie z rakiem piersi występuje choroba z receptorami hormonalnymi (HR+).1 tamoksyfen-selektywny modulator receptora estrogenowego o działaniu estrogenowym na kości, tkankę endometrium i lipidy oraz anty!= działanie estrogenne na tkankę piersiową — była standardową terapią HR+ raka piersi u kobiet po menopauzie, aż do wprowadzenia selektywnych inhibitorów aromatazy trzeciej generacji (AIS).2-4 te środki-anastrozol, letrozol i eksemestan-wykazały lepsze przeżycie wolne od choroby (DFS) w porównaniu z tamoksyfenem w badaniach klinicznych.3,4 działania niepożądane związane ze stosowaniem tamoksyfenu-rak endometrium, powikłania zakrzepowo-zatorowe i oporność na tamoksyfen-zachęciły do rozwoju terapii o innym mechanizmie działania, takich jak AIs.2
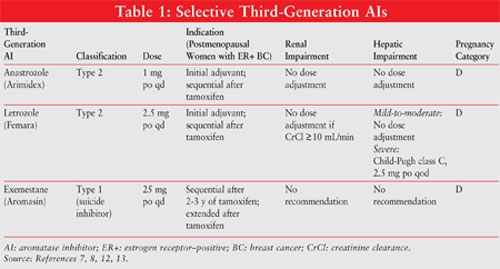
podsumowanie ważnych informacji na temat AIs trzeciej generacji znajduje się w tabeli 1.
Tło
Szkocki chirurg George Beatson opisał hormonalny udział estrogenów w karcynogenezie w związku z rakiem piersi w 1896 R. 5 Beatson uznał, że usunięcie jajników (jajników) było korzystne u kobiet z nieoperacyjnym rakiem piersi.5 Ten chirurgicznie wywołany stan deprywacji estrogenu przyczynił się do zahamowania wzrostu guza w komórkach raka piersi u kobiet z chorobą HR+.5
Aminoglutethimid, pierwotnie sformułowany jako środek przeciwdrgawkowy, był pierwszym niespecyficznym AI początkowo promowanym pod koniec lat 70.jako środek drugiego rzutu po tamoksyfenie u kobiet po menopauzie z zaawansowanym rakiem piersi HR+.Toksyczne działania niepożądane, takie jak zahamowanie czynności nadnerczy i konieczność stosowania terapii steroidowej, doprowadziły do wycofania aminoglutetymidu z obrotu.U kobiet po menopauzie z wczesnym i późnym stadium HR + raka piersi, AIs trzeciej generacji wykazują lepszy profil toksyczności, większą selektywność, większą siłę działania i lepszą skuteczność kliniczną w porównaniu ze starszymi lekami. 6
Klasyfikacja4,7
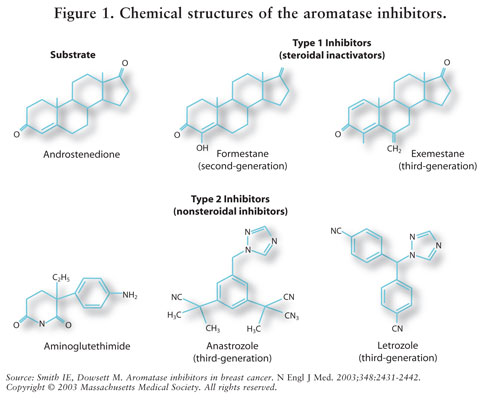
AIS są klasyfikowane jako inhibitory steroidowe typu 1 (niekonkurencyjne, nieodwracalne) lub niesteroidowe typu 2 (konkurencyjne, odwracalne). Eksemestan, inhibitor typu 1, wiąże się nieodwracalnie z miejscem w cząsteczce aromatazy i jest znany jako inhibitor samobójczy. Inhibitory typu 2 anastrozol i letrozol wiążą się odwracalnie do aromatazy. Patrz rysunek 1 dla struktur chemicznych różnych AIs.
mechanizm działania
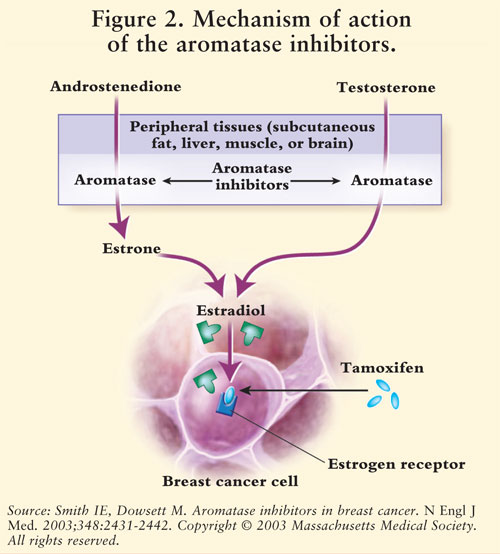
synteza estrogenu odbywa się za pośrednictwem enzymu aromatazy.7 aromataza przekształca androstendion i testosteron w estron i estradiol.5,7 AIs zmniejsza estrogen u kobiet po menopauzie, hamując w ten sposób jego rakotwórczy wpływ na tkankę piersiową.Ponieważ jajniki kobiet przed menopauzą nadal funkcjonują, AIs nie są wskazane dla tej populacji poza badaniami klinicznymi; u tych kobiet AIs stymulowałoby podwzgórze i przysadkę mózgową w celu zwiększenia produkcji gonadotropin.4 patrz rysunek 2.
Toksyczne6,8
niekorzystne skutki AIs obejmują zaburzenia czynności układu sercowo-naczyniowego, takie jak nadciśnienie, rozszerzenie naczyń krwionośnych, obrzęk i ból w klatce piersiowej. Konieczne są dalsze badania w celu oceny pełnego wpływu AIs na czynność serca. U pacjentów może wystąpić zmniejszenie gęstości mineralnej kości (BMD), zwiększone ryzyko złamań, objawy naczynioruchowe, suchość pochwy, ból mięśniowo-szkieletowy, ból głowy, bezsenność, depresja, wzmożony kaszel, duszność, dyskomfort żołądkowo-jelitowy, zwiększenie masy ciała i prawdopodobnie zwiększenie stężenia lipidów. Utrata masy kostnej jest dominującym działaniem niepożądanym; w celu jej przeciwdziałania zastosowano bisfosfoniany, takie jak kwas zoledronowy. Pacjenci z AIs powinni otrzymywać suplementację witaminą D i wapniem. Przedłużające się niekorzystne skutki i wpływ na funkcje poznawcze terapii sztucznej inteligencji nie zostały jeszcze ustalone.AI są przeciwwskazane u kobiet w ciąży.
interakcje między lekami
Anastrozol hamuje CYP1A2, CYP2C9 i CYP3A4.10,11 Letrozol jest metabolizowany przez CYP2A6 i CYP2C19, a eksemestan metabolizuje CYP3A4.8,10-13 induktory CYP3A4, takie jak ryfampicyna, fenytoina, karbamazepina i ziele dziurawca może powodować zmniejszenie stężenia eksemestanu podczas jednoczesnego stosowania. 8,12,13 tamoksyfen powoduje 38% zmniejszenie letrozolu i 27% zmniejszenie anastrozolu podczas jednoczesnego podawania.2,7,8,14
wskazania i dawkowanie
Anastrozol 10,11: Anastrozol w dawce 1 mg raz na dobę jest wskazany we wczesnym raku piersi jako wstępna terapia uzupełniająca u kobiet po menopauzie z chorobą hormonalnie wrażliwą oraz jako pierwsza linia leczenia HR+ lub HR-nieznana choroba przerzutowa lub miejscowo zaawansowana. Jest również dopuszczony do stosowania po terapii tamoksyfenem u kobiet z postępującą chorobą. Dostosowanie dawki nie jest konieczne w przypadku zaburzeń czynności nerek lub łagodnych do umiarkowanych zaburzeń czynności wątroby.
Letrozol11,12: Letrozol 2.5 mg raz na dobę jest wskazane u kobiet po menopauzie z HR + we wczesnym stadium raka piersi jako Leczenie początkowe lub jako Rozszerzona terapia uzupełniająca po podaniu tamoksyfenu. Jest również wskazany w leczeniu przerzutów HR+ lub HR-unknown. Zaleca się dostosowanie dawki w przypadku ciężkich zaburzeń czynności wątroby.
Eksemestan11,14: eksemestan w dawce 25 mg raz na dobę jest wskazany jako leczenie uzupełniające dwa do trzech lat po podaniu tamoksyfenu u kobiet po menopauzie z HR+ wczesnym rakiem piersi, przez łącznie pięć kolejnych lat terapii hormonalnej. Może być również stosowany w chorobie, która postępuje po terapii tamoksyfenem. Lek należy przyjmować po posiłku. Dostosowanie dawki nie jest konieczne w przypadku niewydolności wątroby lub nerek
badania kliniczne
działania toksyczne związane z tamoksyfenem, takie jak rak endometrium, skłoniły do rozpoczęcia zakrojonych na szeroką skalę badań klinicznych oceniających stosowanie AIs trzeciej generacji u kobiet po menopauzie z HR+ rakiem piersi. Do oceny działania tych środków w porównaniu z tamoksyfenem wykorzystano różne wzory badań.6 lepsze wyniki pod względem skuteczności klinicznej i profili toksyczności ustanowiły AIs jako nowy standard leczenia uzupełniającego u kobiet po menopauzie z HR+ rakiem piersi.
ATAC15: ATAC (Arimidex, tamoksyfen sam lub w skojarzeniu), wieloośrodkowe, randomizowane, podwójnie zaślepione badanie, porównywało trzy grupy leczenia: tamoksyfen 20 mg + anastrozol placebo, anastrozol 1 mg + tamoksyfen placebo i połączenie tamoksyfenu 20 mg + anastrozol 1 mg. Głównym celem była ocena bezpieczeństwa i skuteczności tamoksyfenu w porównaniu z anastrozolem oraz kombinacji anastrozolu i tamoksyfenu w ciągu pięciu lat. Łącznie 9366 pacjentów-3125 w ramieniu anastrozolu, 3116 w ramieniu tamoksyfenu i 3125 w ramieniu złożonym-leczono przez medianę 33 miesięcy.
po trzech latach anastrozol wykazał DFS wynoszący 89,4% w porównaniu z 87,4% dla tamoksyfenu (współczynnik ryzyka 0,83, 95% CI, P =.013). Anastrozol zmniejszał częstość występowania kontralateralnego raka piersi (CLBC) w porównaniu z tamoksyfenem (iloraz szans 0,42, 95% CI , P =.007). Ramię złożone zostało zamknięte, ponieważ nie stwierdzono żadnych korzyści klinicznych poza tamoksyfenem. Anastrozol był związany z działaniami niepożądanymi, takimi jak rak endometrium (P =.02), krwawienie z pochwy, wydzielina (P <.0001), zdarzenia naczyniowo-mózgowe (P =.0006), żylne zdarzenia zakrzepowo-zatorowe (P =.0006) i uderzenia gorąca (P <.0001); tamoksyfen był związany z mniejszą liczbą złamań i mniejszym bólem stawów (P <.0001). Po 68 miesiącach anastrozol zwiększał DFS (HR 0,87, 95% CI, P =.01) i czas do nawrotu (HR 0, 79 , 95% CI, P =.0005) i zmniejszone przerzuty odległe (HR 0, 86 , 95% CI, P =.04) I CLBC (zmniejszenie o 42%, P =.01).Po medianie okresu obserwacji wynoszącej 100 miesięcy u pacjentów z HR+ otrzymujących anastrozol wykazano poprawę DFS (HR 0, 85; P =.003), występowanie CLBC (HR 0, 60, P =.004), czas do nawrotu (HR 0, 76, P =.0001) i czas do odległego nawrotu (HR 0,84, P =.022) w porównaniu z pacjentami przyjmującymi tamoksyfen. Bezwzględna różnica w częstości nawrotów poprawiła się z 2.8% po pięciu latach do 4,8% po dziewięciu latach. Częstość złamań anastrozolu była większa podczas leczenia, ale różnica znacznie się zmniejszyła po 100-miesięcznym okresie obserwacji. W przedłużonym okresie leczenia ryzyko złamania wynosiło 1,15 w przypadku anastrozolu w porównaniu z 1,02 w przypadku tamoksyfenu. Ryzyko raka endometrium było zmniejszone w trakcie leczenia anastrozolem i po jego zakończeniu w porównaniu z tamoksyfenem, z rocznym wskaźnikiem odpowiednio 0, 043 w porównaniu z 0, 14 i 0, 014 w porównaniu z 0, 12. Nie stwierdzono różnicy w całkowitym czasie przeżycia (OS).
MA.1712,17: MA17 było randomizowanym, kontrolowanym placebo, podwójnie ślepym badaniem oceniającym skuteczność pięcioletniego leczenia letrozolem u kobiet po menopauzie z rakiem piersi, które ukończyły już pięcioletnie leczenie adiuwantem tamoksyfenem. Pacjenci otrzymywali letrozol w dawce 2,5 mg lub placebo na dobę przez pięć lat. Pierwszorzędowym punktem końcowym był DFS; drugorzędowymi punktami końcowymi były jakość życia, Rozszerzony profil bezpieczeństwa i OS. Spośród 5187 pacjentów, 2593 otrzymywało letrozol, a 2594 otrzymywało placebo; mediana okresu obserwacji wynosiła 2,4 roku.
we wstępnej analizie stwierdzono 207 miejscowych lub przerzutowych nawrotów raka piersi lub początkowych nowotworów złośliwych clbc, 75 w grupie letrozolu i 132 w grupie placebo. Przewidywane czteroletnie stawki DFS dla obu grup wynosiły odpowiednio 93% i 87% (P ?.001 do oceny DFS). W ramieniu letrozolu DFS miał HR 0,61 (95% CI , P ?.001). Letrozol wykazywał zmniejszenie częstości występowania raka piersi o 43% (HR 0, 57; 95% CI, P =.00008).4 z wyjątkiem pacjentów z dodatnim węzłem (P =.04), OS nie osiągnęło istotności statystycznej (HR 0,82, P =.30).U 4 pacjentów w ramieniu letrozolu występowały objawy naczynioruchowe niskiego stopnia, bóle mięśni i zapalenie stawów. Osteoporoza występowała częściej (choć nie istotnie) w grupie otrzymującej letrozol w porównaniu z placebo (5,8% vs 4,5%; P =.07), a częstość złamań była porównywalna między ramionami. Badanie zostało zamknięte po medianie 2,4 roku z powodu zmniejszenia liczby przypadków raka piersi w ramieniu letrozolu. Rozszerzona terapia adiuwantowa letrozolem po zakończeniu pięciu lat tamoksyfenu poprawiła DFS.
BIG 1-987,9,18: badanie Breast International Group (BIG) 1-98, wieloośrodkowe, randomizowane badanie z podwójnie ślepą próbą, objęło 8028 kobiet po menopauzie z HR+ wczesnym stadium raka piersi. Badanie obejmowało cztery grupy terapeutyczne, które oceniały pięcioletnią monoterapię tamoksyfenem, pięcioletnią monoterapię letrozolem, tamoksyfen przez dwa lata, następnie zmianę na letrozol przez trzy lata lub letrozol przez dwa lata, a następnie zmianę na tamoksyfen przez trzy lata. Głównym celem był DFS; drugorzędnymi celami były czas do odległych przerzutów, Bezpieczeństwo i OS. DFS zwiększył się u pacjentów, którzy otrzymywali letrozol w porównaniu z pacjentami, którzy otrzymywali tamoksyfen (HR 0,81, 95% CI, względne zmniejszenie 19%, P =.003), z bezwzględną różnicą 1,5% po trzech latach. Tamoksyfen zwiększał częstość występowania zdarzeń zakrzepowo-zatorowych w porównaniu z letrozolem (lub 0, 38, P <.0001). Złamania kości były zwiększone w ramieniu letrozolu (lub 1,44, P =.006).
IES14,19: IES (Intergroup Exemestane Study) było randomizowanym, podwójnie zaślepionym, wieloośrodkowym badaniem fazy III, którego celem było określenie, czy zmiana na Exemestan po dwóch do trzech latach stosowania tamoksyfenu była bardziej skuteczna niż kontynuowanie tamoksyfenu przez pięć lat. Do badania włączono 4742 kobiety po menopauzie randomizowane do dwóch grup leczenia; 2362 pacjentki miały przestawić się na Exemestan w dawce 25 mg podawanej raz na dobę po dwóch do trzech latach leczenia tamoksyfenem w dawce 20 mg podawanym raz na dobę, aby ukończyć pięcioletnią terapię, a pozostałe 2380 pacjentek otrzymywało tamoksyfen w dawce 20 mg podawanej raz na dobę przez pięć lat. Pierwszorzędowym punktem końcowym był DFS; drugorzędowymi punktami końcowymi były OS, Rozszerzony profil toksyczności i częstość występowania CLBC.
zdarzenia niepożądane, które wystąpiły w ciągu mediany 30, 6 miesiąca, obejmowały częstość występowania CLBC, nawrotów miejscowych lub przerzutowych oraz zgon. Było 449 zdarzeń–183 w ramieniu eksemestanu i 266 w ramieniu tamoksyfenu. W ramieniu z eksemestanem wskaźnik HR wynosił 0 , 68 (95% CI, P <.001 przez test log-rank), który wykazał 32% spadek ryzyka i był analogiczny do przewagi w DFS na poziomie 4.75 (95% CI ) po trzech latach. Po trzech latach w ramieniu z eksemestanem DFS wynosił 91,5% (95% CI) w porównaniu z 86,8% (95% CI ) w ramieniu z tamoksyfenem. Nie stwierdzono istotnej różnicy w OS pomiędzy tymi dwiema grupami, z 93 zgonami w ramieniu z eksemestanem i 106 zgonami w ramieniu z tamoksyfenem. Stwierdzono istotną różnicę w częstości występowania CLBC (P =.04) – 20 osób w ramieniu tamoksyfenu i 9 w ramieniu eksemestanu. Stosowanie eksemestanu w celu zakończenia pięcioletniego leczenia po dwóch do trzech latach tamoksyfenu poprawiło DFS w porównaniu z pięcioletnim tamoksyfenem.
Zapobieganie utracie kości przez terapię AI20
kobiety po menopauzie mają skłonność do rozwoju zmniejszonej BMD z powodu obniżonego poziomu estrogenu. Terapia Sztuczną Inteligencją u pacjentek z rakiem piersi po menopauzie nasila tę tendencję. Denosumab, w pełni ludzkie monoklonalne przeciwciało badane, wiąże aktywator receptora dla ligandu czynnika jądrowego kB (RANKL) i zapobiega aktywności RANKL. RANKL ma kluczowe znaczenie dla aktywności osteoklastycznej, co oznacza rozpad kości. Denosumab i ryzedronian, bisfosfonian, są oceniane pod kątem ich zdolności do przeciwdziałania utracie kości związanej z terapią AI.
badanie Denosumabu20: wieloośrodkowe, randomizowane badanie III Fazy oceniało stosowanie denosumabu w dawce 60 mg podawanego podskórnie raz na sześć miesięcy u kobiet po menopauzie przyjmujących AIs z powodu HR+ niemetastatycznego raka piersi. Celem była ocena zmiany BMD odcinka lędźwiowo-kręgosłupa w stosunku do wartości wyjściowych do 12 miesięcy. Spośród 252 pacjentów 127 przydzielono do grupy otrzymującej denosumab, a 125 do grupy otrzymującej placebo. Obie grupy otrzymywały wapń i witaminę D. BMD oceniano za pomocą dwuenergetycznej absorptiometrii rentgenowskiej. Po 12 i 24 miesiącach leczenia denosumabem lub placebo, stwierdzono różnicę odpowiednio 5,5% i 7,6% w zwiększeniu BMD w odcinku lędźwiowo-kręgosłupa na korzyść denosumabu (P <.0001 Dla obu miesięcy). Denosumab wykazywał porównywalny profil toksyczności w porównaniu z placebo. Leczenie denosumabem przez ponad 24 miesiące nie zostało jeszcze ocenione.
IBIS-II Bone Sub-Study21: Sub-badanie kości International Breast Cancer Intervention Study-II (IBIS-II) zostało przeprowadzone na podstawie badania IBIS-II, w którym oceniano kobiety po menopauzie ze zwiększonym prawdopodobieństwem zachorowania na raka piersi, randomizowane do grupy anastrozolu lub placebo przez pięć lat. Substudy, z aktualną rekrutacją 700 pacjentów, ocenia ryzedronian w porównaniu z placebo w zapobieganiu utracie BMD u kobiet z niskim T-score na początku. Podgrupę pacjentów z badania IBIS-II przydzielono do jednej z trzech różnych strategii leczenia w tym badaniu. Po roku leczenia 350 pacjentów z anastrozolem i 350 pacjentów z placebo z IBIS-II otrzymało wyniki badań substytucyjnych. Grupa 1 obejmowała 227 pacjentów otrzymujących anastrozol z prawidłowym wynikiem T (T-score ?1), Grupa 2 obejmowała 80 pacjentów z osteopenią (ñ2, 5 ? Grupa 3 obejmowała 43 pacjentów z osteoporozą (ñ4 <T-score <), którym przypisano ryzedronian w dawce 35 mg raz w tygodniu.
u pacjentów z osteopenią lub osteoporozą na początku badania, ryzedronian wydawał się hamować utratę kości związaną z anastrozolem. W warstwie II ryzedronian wykazywał korzystny wpływ na zachowanie BMD w całym odcinku biodrowym, ale nie w odcinku lędźwiowym kręgosłupa (P =.005 i P =.W porównaniu z placebo). Ryzedronian nie powodował poważnych działań niepożądanych ani interakcji z innymi lekami.
badanie AIs u kobiet przed menopauzą (miękkie)21-26
około 33% kobiet w wieku poniżej 50 lat zostanie zdiagnozowanych z inwazyjnym rakiem piersi. Badanie supresji funkcji jajników (SOFT, IBCSG 24-02, BIG 2-02)bada zastosowanie terapii AI u kobiet przedmenopauzalnych z HR+ rakiem piersi. Badanie, w którym docelowa liczba pacjentów wynosi 3000, obejmuje kobiety przedmenopauzalne z HR+ rakiem piersi, które ukończyły chemioterapię lub przeszły tylko operację. Ablacja jajników jest ustalana poprzez podawanie triptoreliny (hormon uwalniający gonadotropinę) raz w miesiącu przez pięć lat, chirurgiczne usunięcie jajników lub napromieniowanie miednicy. Pacjenci zostaną przydzieleni losowo do jednego z trzech ramion, z pierwszym ramieniem otrzymującym tamoksyfen raz na dobę przez pięć lat, drugim ramieniem otrzymującym tamoksyfen przez pięć lat w połączeniu z ablacją jajników, a trzecim ramieniem otrzymującym eksemestan przez pięć lat w połączeniu z ablacją jajników. Pacjenci będą otrzymywać eksemestan lub tamoksyfen przez pięć lat.
testy Chemoprewencji23-27
tamoksyfen jest wskazany w chemioprewencji raka piersi.6 jego profil toksyczności jest przyczyną ograniczeń w odniesieniu do stosowania terapeutycznego.AIs może zmniejszać częstość występowania HR+ raka piersi u pacjentów wysokiego ryzyka z powodu zmniejszenia częstości występowania CLBC w porównaniu z tamoksyfenem w badaniach klinicznych, takich jak ATAC.6
badania chemoprewencji AI obejmują badanie International Breast Cancer Study Group (IBCSG) trial 31-03 (IBCSG 31-03) i National Cancer Institute of Canada ’ s MAP.3 Próba. Głównym celem wieloośrodkowego, międzynarodowego, randomizowanego, kontrolowanego placebo badania IBCSG 31-03 jest ocena stosowania anastrozolu w zapobieganiu rakowi piersi u kobiet po menopauzie. Jego podstawowym miarą wyników jest częstość występowania inwazyjnego i nieinwazyjnego raka piersi; wtórnym miarą wyników jest częstość występowania osteoporozy i złamań.5 badanie IBCSG 31-03 ma docelową liczbę 6000 osób. Mapa.W badaniu oceniano eksemestan jako środek chemoprewencyjny u kobiet po menopauzie. Głównym celem mapy kontrolowanej placebo.Badanie ma na celu ocenę skuteczności eksemestanu w zmniejszaniu częstości występowania inwazyjnego raka piersi.
potencjalne przyszłe zastosowania: opisy przypadków
Letrozol został użyty po niepowodzeniu klomifenu w indukowaniu płodności u 22 kobiet z zespołem policystycznych jajników. Letrozol wywołał owulację w 75% cykli w porównaniu do 44,4% cykli indukowanych klomifenem. Cztery ciąże wynikały z owulacji wywołanych przez letrozol i nie obserwowano istotnych działań niepożądanych związanych z letrozolem.28,29
57-letnia otyła kobieta z endometriozą po histerektomii i obustronnej resekcji jajników i jajników otrzymała anastrozol po terapii megestrolem. Po dziewięciu miesiącach u pacjenta nie stwierdzono zmian endometrium.28,30
pacjentowi z zespołem McCune-Albrighta podano anastrozol na przedwczesne dojrzewanie; estradiol u pacjenta normalizował się po 2,5 roku anastrozolu, a wiek kostny wzrósł o sześć miesięcy.28,31 zwiększone stężenie estrogenu może wywoływać ginekomastię i hipogonadyzm hipogonadotropowy.28,31 zmniejszenie estrogenu z AI spowodowało normalną gonadotropinę i testosteron u mężczyzn z ginekomastią i hipogonadyzmem hipogonadotropowym. 28,31,32
Letrozol badano u pacjentów z nawrotowym rakiem jajnika; u pacjentów, którzy otrzymywali letrozol, stabilizacja choroby nastąpiła.28,33 neoadiuwantowego letrozolu podano 10 kobietom po menopauzie z rakiem endometrium; lek wykazał konstruktywne zmiany kliniczne i nie miał negatywnego wpływu chirurgicznego.
gdy porównywano leczenie testolaktonem w porównaniu z anastrozolem u niepłodnych mężczyzn, skuteczność obu leków była podobna.U 28,35 pacjentów z zespołem Klinefeltera stosowano skuteczniejsze leczenie testolaktonem niż anastrozolem.28,35
wnioski
AI trzeciej generacji wykazały lepszy DFS u kobiet po menopauzie z HR+ rakiem piersi, ale korzyści kliniczne z ponad pięcioletniej terapii AI u tych pacjentów nie zostały ustalone.4 Badanie National Surgical Adjuvant Breast and Bowel Project (nsabp) B-33 (exemestane) i późniejsza randomizacja MA.17 (letrozol) badanie zbada stosowanie tych AIs w porównaniu z placebo przez dodatkowe pięć lat.AI są odpowiednią alternatywą dla kobiet po menopauzie, u których tamoksyfen jest przeciwwskazany.4
korzystne działanie AIs trzeciej generacji obejmuje bardziej tolerowany profil toksyczności i lepsze DFS w porównaniu z tamoksyfenem. Poziom skuteczności tych leków i tamoksyfenu jest porównywalny. Pozostaje niepewność co do wybranego czasu trwania leczenia, profilu toksyczności długoterminowej oraz właściwej kolejności podawania dla AIs.4 nowe badania są potrzebne do wytworzenia selektywnych modulatorów aromatazy, które będą produkować mniejszą toksyczność niż AIs.25,36-37
1. Robertson JFR. Fulwestrant (FaslodexÆ) – jak zrobić dobry lek lepiej. Onkolog . 2007;12:774-784.
2. Osborne CK. Terapia lekowa: tamoksyfen w leczeniu raka piersi. N Engl J Med. 1998;339:1609-1618.
3. National Cancer Comprehensive Network. NCCN clinical practice guidelines in oncology — V.1. 2008. Rak piersi. www.nccn.org/professionals/physician_gls/f_guidelines.asp. dostęp 11 października 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology Technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopauzal women with hormone receptor-positive breast cancer: status report 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Zapobieganie nowotworom hormonalnym: rak piersi. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. inhibitory aromatazy w raku piersi. N Engl J Med. 2003;348:2431-2442.
7. Goss PE. Strasser K. Inhibitory aromatazy w leczeniu i profilaktyce raka piersi. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, eds. Podręcznik Informacji O Lekach. 13th ed. Hudson, OH: Lexi-Comp; 2005:117,598,871.
9. Ellis MJ, ed. Inhibitory aromatazy do leczenia raka piersi. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Arimidex (anastrozol) ulotka informacyjna. Wilmington, DE: AstraZeneca Pharmaceuticals LP; maj 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses = ogst& section_id = 148&show=dept&article_id=9884. [Dostęp 17 Marca 2008]
14. Aromasin (exemestane) ulotka dla pacjenta. New York, New York: Pfizer Inc; February 2007.
15. Baum M, Budzar AU, Cuzick J, et al, dla grupy Trialistów ATAC. Anastrozol w monoterapii lub w skojarzeniu z tamoksyfenem w porównaniu z samym tamoksyfenem w leczeniu uzupełniającym kobiet po menopauzie z wczesnym rakiem piersi: pierwsze wyniki randomizowanego badania ATAC. Lancet. 2002;359:2131-2139.
16. Howell a, Cuzick J, Baum m i in. dla grupy Trialistów ATAC. Wyniki badania ATAC (Arimidex, tamoksyfen, sam lub w skojarzeniu) po zakończeniu 5-letniego leczenia uzupełniającego raka piersi. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino s, et al. Randomizowane badanie letrozolu u kobiet po menopauzie po pięciu latach terapii tamoksyfenem we wczesnym stadium raka piersi. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah a, Coates as, et al, for the Breast International Group (BIG) 1-98 Collaborative Group. Porównanie letrozolu i tamoksyfenu u kobiet po menopauzie z wczesnym rakiem piersi. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, for the Intergroup Exemestane Study. Randomizowane badanie eksemestanu po dwóch do trzech latach leczenia tamoksyfenem u kobiet po menopauzie z pierwotnym rakiem piersi. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. Badanie fazy 3 dotyczące wpływu leczenia denosumabem na gęstość mineralną kości u kobiet otrzymujących inhibitory aromatazy w przypadku raka piersi bez przerzutów. Referat prezentowany na: 30th Annual San Antonio Breast Cancer Symposium; December 13-16, 2007; San Antonio, TX. Streszczenie 47.
21. Singh s, Cuzick J, Edwards R, et al. Wpływ anastrozolu na gęstość mineralną kości po roku leczenia: wyniki sub-badania kości międzynarodowego badania interwencyjnego raka piersi (IBIS-II). Referat prezentowany na: the 30th Annual San Antonio Breast Cancer Symposium; December 13-16, 2007; San Antonio, TX. Streszczenie 28.
22. Dellapasqua S, Colleoni m, Gelber RD, Goldhirsch A. adiuwantowa terapia endokrynologiczna dla kobiet przedmenopauzalnych z wczesnym rakiem piersi. J Clin Oncol. 2005;23:1736-1750.
23. National Cancer Institute. Leczenie raka piersi (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. dostęp 26 grudnia 2007.
24. Badania kliniczne Baylor College Of Medicine. Zahamowanie czynności jajników (miękkie). www.breastcenter.tmc.edu/clinic/trials/soft.htm. dostęp 26 grudnia 2007.
25. Aebi s, Castiglione-Gertsch M. Adjuvant endocrine therapy for the very young patients. Piersi. 2003;12:509-515.
26. ClinicalTrials.gov. zahamowanie czynności jajników plus tamoksyfen lub eksemestan w porównaniu z samym tamoksyfenem w leczeniu kobiet przed menopauzą z rakiem piersi reagującym na hormony. www.clinicaltrials.gov [dostęp 26 grudnia 2007].
27. Cuzick J. Inhibitory aromatazy do zapobiegania rakowi piersi. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, OruÁ s, Koyuncu FM. Inhibitory aromatazy: możliwe przyszłe zastosowania. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Zastosowanie inhibitora aromatazy do indukcji owulacji u pacjentów z niewystarczającą odpowiedzią na cytrynian klomifenu. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang s, Fang z i in. Rola aromatazy w chorobie endometrium. J Steroid Biochem Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Zastosowanie inhibitorów aromatazy w przedwczesnym okresie dojrzewania. Rak Endokr. 1999;6:303-306.
32. Shozu m, Sebastian S, Takayama K, et al. Nadmiar estrogenu związany z nowymi mutacjami gain-of-function wpływającymi na gen aromatazy. N Engl J Med. 2003;348:1855-1865.
33. Bowman a, Gabra H, Langdon SP, et al. Odpowiedź CA 125 jest związana z ekspresją receptora estrogenowego w badaniu II Fazy letrozolu w raku jajnika: identyfikacja podgrupy wrażliwej na układ hormonalny. Clin Cancer Res. 2002; 8: 2233-2239.
34. Berstein L, Maximov S, Gershfeld e, et al. Neoadiuwantowa terapia raka endometrium z inhibitorem aromatazy letrozolem: działanie endokrynologiczne i kliniczne. Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Inhibitory aromatazy dla męskiej niepłodności. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. Aromatase and its inhibitors: significance for breast cancer therapy. Recent Prog Horm Res. 2002; 57: 317-338.