teoria hybrydyzacji jest często postrzegana jako długa i myląca koncepcja i jest przydatną umiejętnością, aby móc szybko określić, czy atom jest sp3, sp2 lub sp bez konieczności przechodzenia przez wszystkie szczegóły dotyczące hybrydyzacji.
na szczęście jest w tym skrót i w tym poście postaram się podsumować to w kilku odrębnych krokach, które musisz wykonać.
powiedzmy, że zostaniesz poproszony o określenie stanu hybrydyzacji dla ponumerowanych atomów w następującej cząsteczce:

pierwszą rzeczą, którą musisz zrobić, to określić liczbę grup, które znajdują się na każdym atomie. Przez grupy rozumiemy atomy lub samotne pary elektronów. Jest to również znane jako liczba Steryczna (SN).

poniżej kilka przykładów liczb sterycznych 2-4, które w dużej mierze należy znać w chemii organicznej:

zauważ, że wiązania wielokrotne nie mają znaczenia, są to Atomy + pojedyncze pary dla dowolnego typu wiązania.
gdy już wiesz, jak określić liczbę steryczną (wynika to z teorii VSEPR), wystarczy zastosować następującą korelację:
jeśli liczba steryczna wynosi 4, to SP3
jeśli liczba steryczna wynosi 3 – sp2
jeśli liczbą steryczną jest 2 – SP
więc teraz wróćmy do naszej cząsteczki i określ Stany hybrydyzacji dla wszystkich atomów.
C1 – SN = 3 (trzy połączone Atomy), zatem jest to sp2
C2 – SN = 3 (trzy połączone Atomy), zatem jest to sp2
O4 – SN = 3 (1 atom + 2 samotne pary), zatem jest to sp2
O5 – SN = 4 (2 atomy + 2 samotne pary), zatem jest to sp3
C6 – SN = 4 (4 atomy), zatem jest to sp3
/p>
C7 – Sn = 4 (4 atomy), zatem jest to SP3
N8 – Sn = 4 (3 atomy + 1 samotna para), zatem jest to SP3
C9 – Sn = 2 (2 atomy), zatem jest to SP
C10 – Sn = 2 (2 atomy), zatem jest to SP

oprócz ta metoda jest również bardzo przydatna do zapamiętania niektórych cech związanych ze strukturą i hybrydyzacją. Ogólnie rzecz biorąc, atom ze wszystkimi wiązaniami pojedynczymi jest hybrydyzowany sp3. Najlepszym przykładem są alkany. Wszystkie atomy węgla w alkanie są hybrydyzowane sp3 z geometrią czworościanową.
węgle w alkenach i innych atomach o wiązaniu podwójnym są często hybrydyzowane sp2 i mają trygonalną geometrię planarną.
Wiązanie potrójne jest natomiast charakterystyczne dla alkinów, gdzie atomy węgla są SP-hybrydyzowane.
istnieje kilka typowych wyjątków od tego, co omówiliśmy na temat określania stanu hybrydyzacji i są one głównie związane z metodą, w której patrzymy na rodzaj wiązania atomu.
na przykład w dwutlenku węgla (CO2) węgiel ma dwa wiązania podwójne, ale jest SP-hybrydyzowany.
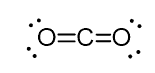
a powodem tego jest fakt, że liczba steryczna węgla wynosi dwa (są tylko dwa atomy tlenu połączone z nim) i aby utrzymać dwa atomy przy 180o, co jest optymalną geometrią, węgiel musi używać dwóch identycznych orbitali. Jest to możliwe tylko w hybrydyzacji sp. Pozostałe dwa orbitale 2p są używane do tworzenia podwójnych wiązań po każdej stronie węgla.
Innym częstym i bardzo ważnym przykładem są karbokacje.

tutaj węgiel ma tylko pojedyncze wiązania i może wyglądać, jakby miał być hybrydyzowany sp3. Jednak węgiel w tego typu karbokacjach jest hybrydyzowany sp2. Ponownie, z tego samego powodu, że jego liczba steryczna wynosi 3 (sp2 – trzy identyczne orbitale).
wyjątek od metody liczby Sterycznej
wyjątek od liczby sterycznej to np. amidy. Atom azotu ma tutaj liczbę steryczną 4 i oczekuje się, że sp3. Jednak ze względu na rezonansową delokalizację samotnej pary, interkonwertuje ona od sp3 do sp2, ponieważ jest to jedyny sposób na posiadanie elektronów w wyrównanym orbitalu p, które mogą na siebie nakładać się i uczestniczyć w stabilizacji rezonansu z elektronami wiązania pi wiązania podwójnego C = O.

w większości przypadków nie musisz się martwić o wyjątki, jeśli przejdziesz na podstawie liczby Sterycznej.