dobrym punktem wyjścia, kiedy trzeba znaleźć konfigurację elektronową jonu, jest konfiguracja elektronowa atomu neutralnego.
w Twoim przypadku musisz znaleźć konfigurację elektronową anionu fluoru, #”F”^ ( -)#, więc zacznij od zapisania konfiguracji elektronowej neutralnego atomu fluoru, #”F”#.
fluor znajduje się w okresie 2, Grupa 17 układu okresowego i ma liczbę atomową # 9#. To mówi, że neutralny atom fluoru ma w sumie 9 elektronów otaczających jego jądro.
jego konfiguracja elektronowa będzie wynosić
#”F:” 1s^2 2s^2 2P^5#
teraz, #”f”^(-)# anion powstaje, gdy #1# elektron zostanie dodany do neutralnego atomu fluoru.
zauważ, że 2P-subshell atomu neutralnego zawiera #5# elektronów. Jego maksymalna pojemność to w rzeczywistości # 6 # elektronów, dwa elektrony na każdy orbital P.
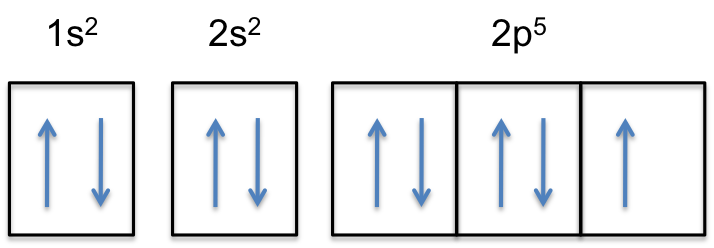
oznacza to, że #kolor(czerwony)(„dodatkowy elektron”)# zostanie dodany do jednego z trzech orbitali 2p, powiedzmy do #2p_y#.
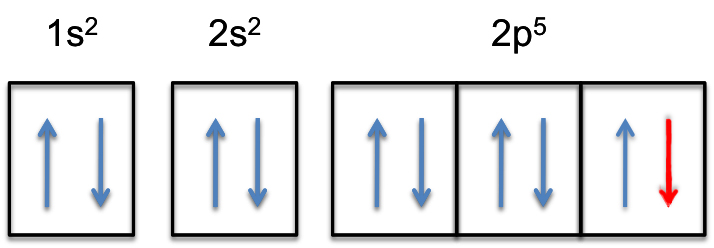
2P-subshell będzie teraz całkowicie wypełniony, tzn. będzie zawierał elektrony #6#.
konfiguracja elektronowa anionu fluorkowego będzie więc
#kolor(zielony) (/bar(UL(kolor(biały)(a / a)kolor(czarny)(„F”^(-):kolor(biały) (a) 1s^2kolor(biały) (a) 2S^2 kolor(biały) (A)2P^6)kolor(biały) (a/a)|)))#
zauważ, że anion fluorkowy ma w sumie elektrony #8# w swojej drugiej powłoce, zewnętrznej powłoce. To mówi, że anion ma kompletny oktet.
ponieważ anion fluorkowy jest izoelektroniczny z neonem, #”Ne”#, możesz zapisać jego konfigurację elektronową używając skrótu gaz szlachetny jako
#”F”^ ( -): #
tutaj
## – konfiguracja elektronowa z neonu