rozważmy delokalizację gęstości elektronów. To jest, gdy gęstość elektronów jest rozłożona w jak największym stopniu w całej cząsteczce, tak, że minimalne nagromadzenie ładunku jest obecne w danym orbitalu.
To jest opisane:
- zbiorczo przez wszystkich uczestników rezonansu w strukturach Lewisa.
- zbiorczo przez wszystkie poszczególne wkłady orbitali molekularnych na diagramach orbitali molekularnych.
(istnieją między nimi subtelne różnice, ale są one z grubsza analogiczne dla prostoty. Więcej szczegółów znajdziesz tutaj.)
lokalizacji gęstości elektronów jest brak.
dzieje się tak, gdy wypełniamy całą gęstość elektronów na kilka orbitali, zamiast ją rozprzestrzeniać, i prawie nigdy tak naprawdę nie dzieje się to w prawdziwej cząsteczce lub układzie kwantowym (nawet jeśli nie ma rezonansu).
przykład ze strukturami rezonansowymi
rozważ wyizolowany (nie reagujący) kation allilowy, #”C”_3″H”_5^(+)#.
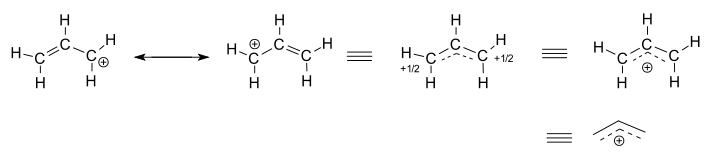
- dwie lewe struktury są źródłami rezonansowymi, z których każda jest zlokalizowaną reprezentacją prawdziwej zdelokalizowanej struktury.
- trzy struktury prawostronne są reprezentacjami rezonansowej struktury hybrydowej lub struktury delokalizowanej.
zdelokalizowana struktura jest zasadniczo opisana przez zbiór wiązanych orbitali molekularnych.
przykład z diagramem orbitalnym molekularnym
rozważmy kation allilowy ponownie na diagramie MO, który opisuje tylko elektrony #bbpi# (tj. elektrony, które byłyby w wiązaniu #pi# w zlokalizowanym wiązaniu podwójnym!), ale pozwala na udział w reakcjach:
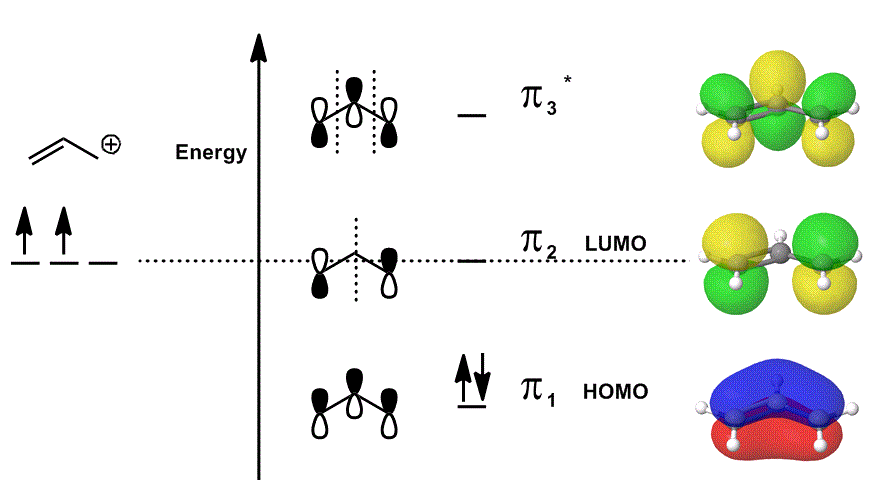
- każdy z wkładów orbitalnych w środku jest przedstawiony jako zlokalizowany; orbitale atomowe, które pokrywałyby się, są pokazane jako same (w tym Faza).
- każdy z orbitali po prawej stronie (po jednym na rząd) jest przedstawiony w zdelokalizowanym; gęstość elektronów może być rozłożona tak, że orbitale molekularne są przedstawione z pełnym uwzględnieniem nakładania się, węzłów i faz.
kiedy nakładasz się na #pi_1#, # pi_2# i # pi_3^”* ” # i włączasz ważony udział tych stanów (ważony według współczynników # c_i#), otrzymujesz liniową kombinację orbitali molekularnych:
#Psi_(„allil”^(+)) = c_1overbrace(pi_1)^”bonding” + c_2overbrace(pi_2)^”nonbonding” + c_3overbrace(pi_3^”*”)^”antibonding”#
i #Psi_(„allil”^(+))# then opisuje ogólny rozkład stanów, które łącznie opisują reaktywność kationu allilowego.
innymi słowy, #pi_1# (który przekazuje elektrony #pi# do wiązania), #pi_2# (który przyjmuje elektrony do wiązania) i #pi_3^”*”# (w tym przypadku rzadko uczestniczy) wszystko robi coś, gdy kation allilowy uczestniczy w reakcji chemicznej, ponieważ (jeśli jest zajęty) istnieją w tym samym czasie.