jaki jest potencjał redox komórki?
tryb czytnika
potencjały redoks służą do scharakteryzowania kosztu wolnej energii i kierunku reakcji z udziałem transferu elektronów, jednej z najbardziej wszechobecnych i ważnych reakcji biochemicznych. Takie reakcje redukcji-utleniania charakteryzują się swobodną zmianą energii, która dzieli pewne cechy koncepcyjne z tymi używanymi do opisu pKa w reakcjach kwasowo-zasadowych, w których uczestniczy transfer protonów, a nie transfer elektronów. W tej winiecie, jednej z najbardziej abstrakcyjnych w książce, omawiamy, w jaki sposób potencjał redoks może być wykorzystany jako miara siły napędowej dla danej reakcji utleniania-redukcji. Dla kontrastu, w przeciwieństwie do pH, nie ma sensu, w którym można przypisać pojedynczy potencjał redoks do całej komórki.
potencjał redoks, a dokładniej potencjał redukcji, związku odnosi się do jego tendencji do pozyskiwania elektronów, a tym samym do redukcji. Niektórzy czytelnicy mogą pamiętać mnemoniczny „OILRIG”, który przypomina nam, że” utlenianie to strata, redukcja to zysk”, gdzie strata i zysk są elektronów. Rozważmy reakcję polegającą na przeniesieniu elektronów: AOX + ne– ↔ ared, w której n elektronów jest pobieranych przez formę utlenioną (AOX), aby otrzymać formę zredukowaną (Ared) związku A. Różnica potencjału redoks ΔE między donorem i akceptorem elektronów jest związana z towarzyszącą zmianą energii swobodnej ΔG reakcji poprzez ΔG=nFΔE, gdzie n to liczba przenoszonych elektronów, A F to stała Faradaya (96,485 J/mol/V lub ≈100 kJ/mol / V). Analizując tabelaryczne wartości tych potencjałów, można rozwinąć intuicję dotyczącą tendencji do przenoszenia elektronów, a tym samym kierunku reakcji.

Rysunek 1: „Wieża redoks” pokazująca potencjał redoks wspólnych metabolicznych pół-reakcji. Procesy metaboliczne mogą być postrzegane jako poruszające się elektrony między cząsteczkami, często przechwytując część energii uwolnionej, gdy elektrony poruszają się z wysokiej energii do niższych stanów energetycznych, jak w glikolizie lub oddychaniu. Elektrony przekazane przez „pół-reakcje” na górze mogą być zużyte w pół-reakcji dolnej na wieży, aby zakończyć termodynamicznie korzystną reakcję. Na przykład, proces netto glikolizy obejmuje utlenianie glukozy do pirogronianu połączone z redukcją NAD + do NADH. Ponieważ utlenianie glukozy leży na szczycie wieży, a redukcja NAD+ znajduje się poniżej niej, ten przepływ elektronów jest korzystny termodynamicznie. W porównaniu do bar hydrolizy ATP możemy również zobaczyć, że ten przepływ elektronów jest na tyle korzystny, aby wytworzyć ATP. Oddychanie tlenowe obejmuje wiele pośrednich transferów elektronów przez łańcuch transportu elektronów. Wykazano kilka z tych przejść, w tym bursztynian utleniania do fumaranu, który jest mechanicznie sprzężony z redukcją ubichinonu do ubichinolu w wewnętrznych błonach mitochrondrialnych. Każdy z tych pośrednich transferów elektronów musi być termodynamicznie korzystny sam w sobie, aby proces oddychania przebiegał. Porównując do „skali hydrolizy ATP” możemy zauważyć, że poszczególne transformacje w łańcuchu transportu elektronów nie są na tyle energiczne, aby samodzielnie wytworzyć ATP. Jednak są one na tyle korzystne, aby pompować proton przez komórkę lub błonę mitochondrialną. To jest energetyczna podstawa chemiosmozy: komórki przechowują kwanty energii zbyt małe dla syntezy ATP w gradiencie protonu przez błonę. Energia ta jest później wykorzystywana do wytworzenia ATP przez przekształcenie gradientu H+ W wiązania fosfoanhydrytowe na ATP przez syntazę ATP.
chociaż ATP jest często uważane za walutę energetyczną komórki, w rzeczywistości dla równowagi energetycznej komórki nośniki energii redukującej są nie mniej ważne. Najważniejszym przykładem tych nośników jest cząsteczka NADH w postaci zredukowanej lub utlenionej (NAD+). Możemy wykorzystać potencjał redoks do połączenia tych dwóch protagonistów molekularnych i oszacować górną granicę liczby cząsteczek ATP, które mogą być wytwarzane z utleniania NADH (wytwarzanego na przykład w cyklu TCA). Para NAD+ / NADH ma potencjał redoks e = -0,32 V i jest utleniana przez tlen, dając wodę (protony pochodzące z mediów) o potencjale redoks e = +0,82 V. oba są pokazane na fig.1 jako część „wieży redoks” kluczowych biologicznych pół-reakcji, które można powiązać, aby znaleźć ogólną zmianę potencjału redoks, a tym samym darmową energię. Dla reakcji rozpatrywanej powyżej utleniania NADH przez tlen, maksymalna związana energia wolna, która może być ekstrahowana, wynosi
ΔG = n X F X ΔE = 2 x 100 kJ/(molxV) x (0,82-(-0,32)) V = 230 kJ/mol≈ 90 kBT,
gdzie N=2 i F≈100kj/mol/V. jako hydroliza ATP ma wolną zmianę energii ≈50kj/mol POD warunki fizjologiczne stwierdzamy, że 228 kJ/mol wystarcza do wytworzenia maksymalnie 228/50≈4,5 ATP. W komórce utlenianie NADH przebiega przez kilka etapów oddychania i powoduje przeniesienie 10 protonów przez błonę w kierunku potencjału elektrochemicznego (BNID 101773). Te transfery protonów odpowiadają jeszcze innemu sposobowi przechwytywania energii biochemicznej. Energia ta jest następnie wykorzystywana przez ATPase do wytworzenia 2-3 ATP. W ten sposób okazuje się, że około połowa energii, która została uwolniona podczas transferu elektronów z NADH do tlenu jest zachowana w ATP. Zapewnienie, że reakcja przebiega w sposób kierunkowy, aby produkować ATP, a nie konsumować, wymaga, aby część energii była „marnowana”, ponieważ system musi być poza równowagą.
Dlaczego warto dyskutować o potencjałach redoks reakcji połowicznych, a nie o wolnych energiach reakcji pełnych? Same jednostki zawdzięczają swoje początki zdolności w dziedzinie elektrochemii do pomiaru w laboratorium różnicy napięcia, czyli potencjału mierzonego w woltach, w dwóch komorach zawierających różne nośniki elektronów i zatrzymania reakcji sieci z napięciem. Przydatność potencjałów redoks dla półreakcji polega na zdolności do łączenia kombinacji różnych donorów i akceptorów w celu oceny termodynamicznej wykonalności i przyrostu energii każdej rozważanej reakcji. Jeśli masz K możliwych związków transferu elektronów, ~ K2 możliwe reakcje mogą być przewidywane na podstawie tylko potencjałów redoks K.
tak jak mówimy o pH roztworu, na pierwszy rzut oka możemy sobie wyobrazić, że można by mówić o pozornie analogicznym potencjale redoks komórki. Znając stężenie zredukowanych i utlenionych form danej pary reakcji definiuje ich potencjał redoks puli poprzez zależność
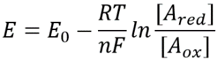
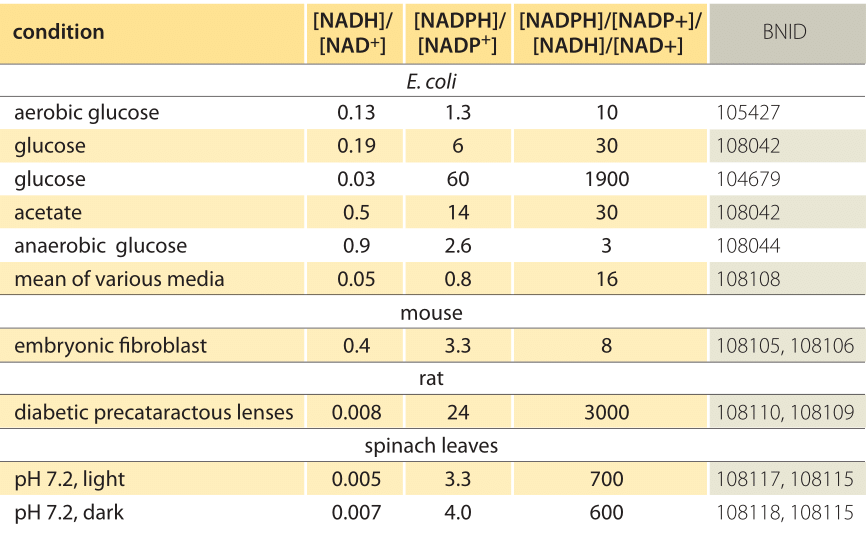
Tabela 1: stosunek stężeń wspólnych par donorów elektronów NAD/NADH i NADP/NADPH. Jak widać pierwszy jest stosunkowo utleniony, a drugi stosunkowo zredukowany ze stosunkiem między nimi zwykle znacznie większym niż 1.
to równanie (tzw. równanie Nernsta) przedstawia wartość potencjału redoks w Warunkach stężenia typowych dla komórki, w przeciwieństwie do standardowych warunków stanu (gdzie z definicji =). Jako przykład, rozważmy oddanie elektronu do NAD+ w wyniku czego powstaje utleniona forma NADH. W matrycy mitochondrialnej podaje się stosunek 10-krotnie większej ilości formy utlenionej (BNID 100779), jak pokazano w tabeli 1. W tym przypadku współczynnik wynosi ≈30 mV, a zatem potencjał redox zmienia się z -0,32 V na -0,29 V. Aby upewnić się, że kierunek efektu, który otrzymaliśmy, jest rozsądny, zauważamy, że przy nadmiarze formy utlenionej tendencja do utleniania się przez tlen jest nieco niższa, o czym świadczy fakt, że potencjał redoks jest teraz bliżej niż wcześniej do potencjału pary wymiany elektronów tlen/woda (+0,82 V).
komórka nie jest w stanie równowagi i istnieje słabe sprzężenie między różnymi parami redoks. Sytuacja ta prowadzi do ustanowienia różnych potencjałów redoks dla współistnienia par redoks w komórce. Jeśli strumienie produkcji i wykorzystania zredukowanych i utlenionych form pary redoks, Ared i Aox oraz innej hodowli i Box, są znacznie większe niż ich strumień interkonwersji, Ared+Box<>AOX+Bred, to a i B mogą mieć bardzo różne potencjały redoks. W rezultacie trudno jest zapytać o ogólny potencjał redoks komórki, ponieważ będzie on różny dla różnych składników w komórce. Dla kontrastu, pH komórki (lub jakiegoś przedziału w niej) jest znacznie lepiej zdefiniowane, ponieważ woda służy jako uniwersalne medium, które łączy różne reakcje kwasowo-zasadowe i równoważy to, co jest znane jako potencjał chemiczny wszystkich gatunków.
dla danej pary redoks w danym przedziale komórkowym stosunek stężenia obu postaci określa potencjał redoks w dobrze określony sposób. Związki, które szybko wymieniają elektrony, będą w równowadze względnej, a tym samym będą miały podobny potencjał redoks. Aby zobaczyć, jak te idee się sprawdzają, najbardziej przydatne jest rozważenie pary redoks, która bierze udział w wielu kluczowych reakcjach komórkowych, a w rezultacie jest ściśle związana ze stanem redoks wielu związków. Glutation w cytoplazmie jest związkiem takim, że bierze udział w redukcji i utlenianiu bardzo rozpowszechnionych wiązań tiolowych (tych zawierających siarkę) w aminokwasach cysteiny wielu białek. Glutation jest tripeptydem (złożonym z 3 aminokwasów), centralnym cysteiną, która może być w formie zredukowanej (GSH) lub utlenionej, gdzie tworzy dimer z cysteiną z innej cząsteczki glutationu (oznaczonej GSSG). Połowa reakcji dla glutationu wynosi zatem 2 x GSH <> GSSG + 2e– + 2h+. Druga połowa reakcji jest często wiązaniem siarkowym, które jest „otwarte” w receptywnym białku, dzięki czemu jest utrzymywane w zredukowanej formie dzięki stałemu działaniu glutationu. Glutation jest również dominującym graczem w neutralizowaniu reaktywnych związków, które mają dużą tendencję do przechwytywania elektronów, a tym samym utleniania innych cząsteczek. Związki takie powstają pod wpływem stresu oksydacyjnego, np. gdy osiągana jest zdolność reakcji przenoszenia elektronów w procesie oddychania lub fotosyntezy. Zbiorczo nazywane ROS (reaktywne formy tlenu) mogą tworzyć spustoszenie w komórce i są zaangażowane w wiele procesów starzenia. Podwójna rola glutationu w utrzymaniu prawidłowego fałdowania białek i ograniczaniu ROS, a także jego stosunkowo wysokie stężenie i reaktywność transferu elektronów sprawiają, że jest on głównym pełnomocnikiem dla stanu redoks komórki. Stężenie glutationu w komórce wynosi ≈10 mm (BNID 104679, 104704, 111464), co czyni go drugim najliczniejszym metabolitem w komórce (po glutaminianie), zapewniając dominującą rolę jako dawca elektronów w kontroli redoks funkcji białka. W innych funkcjach komórek występują inne dominujące pary elektronów. W biosyntetycznych reakcjach anabolicznych para NADP+ / NADPH, a w reakcjach katabolicznych rozpadu jest NAD+ / NADH.
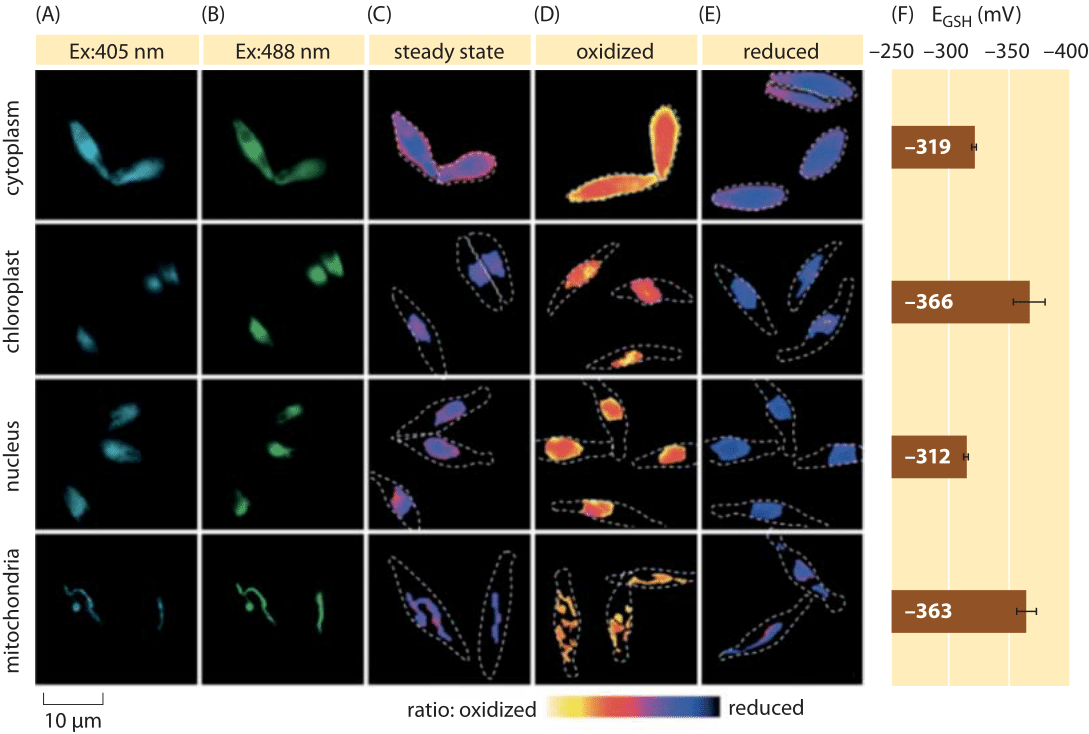
Rysunek 2: obrazowanie potencjału subkomórkowego redoks puli glutationu w glonach okrzemek in vivo. Fluorescence microscopy imaging of p. tricornutum cells expressing roGFP2 in various subcellular localizations. Obrazy fluorescencyjne przy dwóch falach wzbudzenia (A, B) podzielono w celu uzyskania wartości ratiometrycznych (C). W przypadku kalibracji obrazy ratiometryczne są rejestrowane w warunkach silnego utleniacza (150 mM H2O2) (D) i reduktora (1 mM DTT) (E). Przerywane linie reprezentują kontur komórek, narysowany na podstawie jasnych obrazów pola. F) potencjał redoks w stanie stacjonarnym puli glutationowej, EGSH w mV, obliczono na podstawie równania Nernsta, wykorzystując poziom utleniania przy podanych wartościach pH dla każdej organelli. Na podstawie: S. Graff van Creveld et al., ISME J., 9: 385, 2015.
Jak mierzyć potencjał redoks w żywych komórkach? Kolejnym beneficjentem rewolucji fluorescencyjnych białek był temat potencjałów redoks. Reporterowy GFP został zaprojektowany tak, aby był wrażliwy na redoks przez włączenie aminokwasów cysteiny, które wpływają na fluorescencję w oparciu o ich redukcję przez pulę glutationową. Rysunek 2 przedstawia wynik użycia takiego reportera do przyjrzenia się potencjałowi redoks glutationu w różnych przedziałach okrzemki.
z pomiarów stanu redoks puli glutationowej w różnych organelach komórkowych i w różnych warunkach możemy wywnioskować stosunek stężeń form zredukowanych do utlenionych. Wartości wahają się od około -170 mV w ER i komórkach apoptotycznych do około -300 mV w większości innych organelli i komórek proliferacyjnych (BNID 103543, 101823, 111456, 111465). Biorąc pod uwagę, że standardowy potencjał redoks glutationu wynosi -240 mV (BNID 111453, 111463), jaki jest stosunek zredukowanego do utlenionego glutationu? Używając równania Nernsta (lub równoważnie, z rozkładu Boltzmanna), dziesięciokrotna zmiana stosunku iloczynu do reagenta odpowiada wzrostowi ≈6 kJ/mol W energii swobodnej (≈2 kBT). Biorąc pod uwagę 2 elektrony przeniesione w reakcji GSH/GSSG, ta zmiana stosunku stężenia jest zwykle równa 30mV, chociaż dla glutationu, Stechiometria 2 cząsteczek GSH łączących się z jedną cząsteczką GSSG kowalencyjnie związaną, czyni to tylko przybliżeniem. Zmiana 100 mV zgłaszana w różnych warunkach odzwierciedla stosunek stężeń pomiędzy mniej więcej równymi ilościami form zredukowanych i utlenionych (w komórkach apoptotycznych) do ponad 1000 razy większego stężenia formy zredukowanej. W rzeczywistości w większości warunków komórkowych utleniona forma jest tylko bardzo małym ułamkiem ogólnej puli, ale nadal ma implikacje fizjologiczne.
jednym z mylących aspektów reakcji redoks jest to, że transfer może przybierać różne formy. W jednym przypadku są to tylko elektrony, jak w reakcjach prowadzonych przez cytochromy w łańcuchach przenoszenia elektronów. W innym powszechnym przypadku jest to kombinacja elektronów i protonów, jak w kofaktorze NAD+ / NADH, gdzie przenoszone są dwa elektrony i jeden proton (H+). Wreszcie, istnieją reakcje, w których ta sama liczba elektronów i protonów jest przenoszona, gdy naturalnie można by pokusić się o omówienie transferu wodorów. Jest to na przykład przypadek ogólnej reakcji utleniania glukozy, w której tlen jest redukowany do wody. Dwa wodory zostały w ten sposób przeniesione, więc należy omówić transfer elektronów, wodorów lub protonów? Definicja potencjału redoks (podana powyżej)skupia się tylko na „stanie” elektronu. Co z protonami i co się z nimi dzieje, gdy ktoś napotka łańcuch reakcji transferu elektronów, gdzie niektóre związki pośrednie zawierają protony wodoru, a niektóre nie? Wyjaśnienie zachodzi w otaczającej wodzie i jej pH. reakcja zachodzi przy danym pH, a reagujące związki są w równowadze z tym pH i w ten sposób wydzielanie lub otrzymywanie protonu nie ma wpływu na energie. Podłoże wodne służy jako Pula, w której protony mogą być „zaparkowane”, gdy reakcja transferu jest wyłącznie elektronów (analogia zapożyczona z bardzo dostępnej wstępnej książki biochemicznej” the chemistry of life „Stevena Rose’ a). Protony te mogą być zapożyczone z powrotem na kolejnych etapach, tak jak to ma miejsce w końcowym etapie oddychania oksydacyjnego, gdzie oksydaza cytochromowa pobiera protony z pożywki. Ponieważ zakłada się, że woda jest wszechobecna, nie trzeba uwzględniać protonów, z wyjątkiem znajomości dominującego pH, które obrazuje tendencję do dawania lub otrzymywania protonów. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




