by Katarzyna Gara
styczeń 2016—śluz może nie jest czymś, o czym lubimy myśleć, ale od tego zależy nasze życie. W mukowiscydozie (CF) zagęszczenie śluzu prowadzi m.in. do infekcji płuc i blokad jelitowych. Choroba jest spowodowana przez pojedynczy gen, na który wpływa jedna lub więcej z ponad 1700 mutacji, o których wiadomo, że powodują zaburzenie. Na Uniwersytecie Johnsa Hopkinsa naukowcy i genetycy kliniczni pracują razem, aby dowiedzieć się wszystkiego o Genie, jego białku i tym, co dzieje się źle u pacjentów, wiedząc, że każda zdobyta przez nich informacja przybliża ich do możliwości leczenia wszystkich osób z mukowiscydozą.
podaj mi sól
w dzisiejszych czasach pacjenci z mukowiscydozą mają znacznie lepsze wyniki dzięki zabiegom, które radzą sobie z częstymi infekcjami płuc, ale diagnoza mukowiscydozy nadal oznacza długość życia tylko 38 ze względu na pobór opłat za trzustkę, wątrobę i jelita. Problem pochodzi z defektów w genie mukowiscydozy transmembrane conductance regulator (CFTR), który niesie schemat dla białka CFTR. Białko CFTR jest jak gniazdo pocztowe w drzwiach wejściowych. Tworzy małe przejście między wnętrzem i na zewnątrz komórki.
przy prawidłowej pracy, CFTR pomaga kontrolować przepływ jonów chlorkowych (składnika soli) do i z komórki. W płucach i przewodach trzustki, gdy chlorek opuszcza komórki, zachęca wodę do naśladowania. Ta woda pomaga tworzyć cienkie warstwy śluzu. W płucach śluz zatrzymuje kurz i bakterie, których nie powinno tam być. Rzęski, lub struktury włosowate, na komórkach, które linii płuc następnie pasterz śluzu się dróg oddechowych do jamy ustnej, gdzie zostaje połknięty i wysłany do trawienia. W trzustce płyn pomaga przenosić enzymy do jelita, aby pomóc w trawieniu pokarmu. Jeśli śluz jest zbyt lepki w płucach, rzęski nie mogą go wyprowadzić, więc bakterie pozostają tam, aby wywołać infekcje; jeśli jest zbyt lepki w przewodach trzustkowych, enzymy nie docierają do jelita, a jedzenie nie trawi prawidłowo.
ścieżka białka
Garry Cutting, profesor w Instytucie Medycyny genetycznej, i Bill Guggino, Dyrektor Zakładu Fizjologii, badali Gen CFTR i jego kodowane białko przez większość swojej kariery. Zainteresowanie cuttinga wynika z opieki nad parą braci z CF podczas pobytu w Johns Hopkins. Zainteresowanie Guggino sięga jeszcze dalej – do jego wypraw chłopięcych nad morze. Zastanawiał się, jak ryby mogą przetrwać w słonej wodzie i dowiedział się, że krótka odpowiedź brzmi: ich Wersja CFTR.
Jeśli trudno sobie wyobrazić skupienie całej kariery na jednym genie i jego produkcie białkowym, pomyśl o nim jako o złożonej kostce Rubika zbudowanej z łańcucha 1480 bloków magnetycznych (aminokwasów). Mutacja w genie CFTR często oznacza zmianę jednego z aminokwasów, która może dramatycznie wpłynąć na ostateczną trójwymiarową formę.
niektóre mutacje powodują, że białko nie powstaje. Inne pozwalają na zsyntetyzowanie częściowego białka. Im bliżej początku białka występują te mutacje, tym gorzej dla jego funkcji. Inne mutacje występują tylko w niewłaściwym miejscu i uniemożliwiają otwarcie kanału solnego, na przykład. Jeszcze inni nieprawidłowo składają CFTR, co sygnalizuje zespołowi kontroli jakości komórki, aby ją odebrał i poddał recyklingowi. Inne nie zakłócają funkcji białka, ale uniemożliwiają mu przedostanie się do błony plazmatycznej, gdzie wykonuje swoją pracę.
wysiłki Cuttinga i Guggino przyczyniły się do stworzenia na rynku dwóch leków przeciwcukrzycowych: iwakaftora i lumakaftora. Iwakaftor aktywuje CFTR z mutacją G551D. Cutting ’ s lab po raz pierwszy zgłosił tę mutację w 1990 roku, a guggino i Cutting następnie wygenerowali nowe spostrzeżenia na temat wpływu tej mutacji na funkcję CFTR i objawy pacjentów. Niestety mutacja G551D występuje tylko u 4 proc. pacjentów z mukowiscydozą. Okazuje się jednak, że 50 procent pacjentów z mukowiscydozą ma dwie kopie innej mutacji (zwanej delta F508), która powoduje, że CFTR jest słabo uformowany i wysyłany do pojemnika na odpady. Lumacaftor zapobiega recyklingowi, dzięki czemu dociera do błony plazmatycznej. Następnie iwakaftor daje mu „kopa”, którego potrzebuje do pracy.
„delta F508 CFTR nadal jest upośledzony, ale to lepsze niż nic” – mówi Guggino. „A to oznacza, że nie leczymy już tylko objawów. Leczymy przyczyny.”
żadne dziecko nie zostało pozostawione
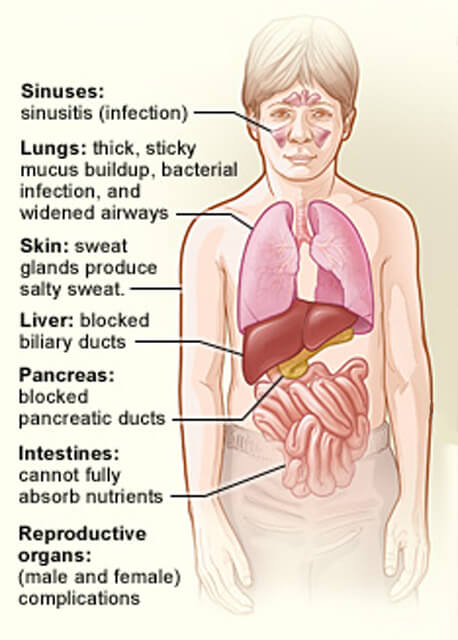 narządy dotknięte mukowiscydozą.
narządy dotknięte mukowiscydozą.kredyt: National Heart, Lung and Blood Institute
ponad 40% pacjentów z mukowiscydozą z innymi mutacjami — niektóre dość rzadkie — nie zawsze ma tyle szczęścia. Istnieje ponad 1700 mutacji w genie CFTR, które powodują CF, a tylko niewielka część została przetestowana pod kątem odpowiedzi na zatwierdzone leki. Niektórzy z badanych reagują na jeden lub drugi lek, ale inni nie. mimo to naukowcy mają nadzieję, że pewnego dnia będą w stanie pomóc wszystkim. Cięcie przewiduje ostatecznie kategoryzację każdego pacjenta według typu, słowo, które wymyślił, aby opisać grupy pacjentów, którzy mogą zareagować na tę samą terapię z powodu wspólnej przyczyny ich objawów. Ściśle współpracuje z Patrickiem Sosnay i Karen Raraigh, aby wydobywać dane z 88 000 osób na całym świecie, aby przetestować jego koncepcję.
możemy wykorzystać informacje generowane przez eksperymenty w komórkach do grupowych mutacji, które wpływają na tę samą właściwość CFTR i dlatego powinny odpowiadać na ten sam panel leków CFTR. Grupowanie mutacji według typu umożliwiłoby badania kliniczne na pacjentach z różnymi mutacjami, zamiast badań klinicznych, które oceniają jedną mutację na raz”, mówi Cutting. „Medycyna precyzyjna staje się rzeczywistością.”
Niestety, terapie oparte na lekach nie będą działać u wszystkich pacjentów z mukowiscydozą, zwłaszcza u 2%, którzy w ogóle nie wytwarzają CFTR. W tym celu naukowcy opracowują sposoby kierowania samego zmutowanego genu, choć nadal istnieje wiele przeszkód do pokonania.
Guggino opracował system terapii genowej, który wykorzystuje zmodyfikowany wirus adeno-associated (AAV) do osadzania dobrej wersji genu CFTR w komórkach. System sprawdził się w ludzkich komórkach dróg oddechowych i gryzoniach.
próbując innego podejścia, Liudmila Cebotaru z Wydziału Medycyny, opracowała nowy sposób łączenia terapii genowej i naprawy białek za pomocą mechanizmu zwanego transkomplementacją. Zamiast umieszczać Pełnowymiarowy Gen CFTR w AAV, używa krótszej wersji, która łatwiej jest wstawić do genomu komórki. Gdy produkowane jest krótsze białko, wiąże się ono ze zmutowanym białkiem pacjenta i pomaga mu dostać się do błony plazmatycznej. Zarówno Cebotaru, jak i Guggino testują teraz jej nowe podejście na małpach rezus, ponieważ ich płuca i układ odpornościowy są bardzo bliskie ludziom”. Mają nadzieję rozpocząć badania kliniczne w ciągu najbliższych kilku lat, jeśli wszystko pójdzie dobrze.
„lubię myśleć o tym jak o przeskakiwaniu akumulatora samochodu” „Przy odrobinie dodatkowej pomocy białka CFTR pacjentów mogą dotrzeć do celu.”
zarówno dla naukowców, jak i pacjentów celem jest nic innego jak lekarstwo na mukowiscydozę. I choć jest jeszcze daleko, są zachęcające oznaki, że możemy się tam dostać.