odwracalne rozprężanie gazu idealnego może być użyte jako przykład procesu izobarycznego. Szczególnie interesujący jest sposób, w jaki ciepło jest przekształcane do pracy, gdy rozprężanie odbywa się przy różnych ciśnieniach gazu roboczego/gazu otaczającego.
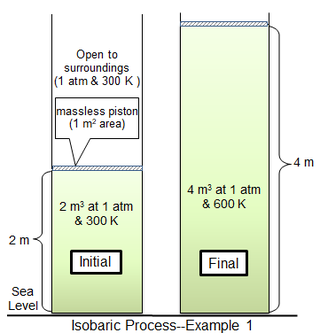
w pierwszym przykładzie procesu cylindryczna komora o powierzchni 1 m2 zawiera 81,2438 mola idealnego dwuatomowego gazu o masie cząsteczkowej 29 g mol−1 w temperaturze 300 K. Otaczający gaz znajduje się przy 1 atm i 300 K, A oddzielony od gazu butli cienkim tłokiem. W przypadku tłoka bezmasowego gaz w butli znajduje się również pod ciśnieniem 1 atm, przy początkowej objętości 2 m3. Ciepło jest dodawane powoli, aż temperatura gazu będzie równomiernie 600 K, po czym objętość gazu wynosi 4 m3, a tłok znajduje się 2 m powyżej swojego początkowego położenia. Jeśli ruch tłoka jest wystarczająco wolny, ciśnienie gazu w każdej chwili będzie miało praktycznie taką samą wartość (psys = 1 atm) w całym procesie.
dla termicznie doskonałego dwuatomowego gazu molowa właściwa Pojemność cieplna przy stałym ciśnieniu (cp) wynosi 7/2R lub 29.1006 J mol−1 deg−1. Molowa pojemność cieplna przy stałej objętości (cv) wynosi 5/2R lub 20,7862 J mol−1 deg−1. Współczynnik γ {\displaystyle \ gamma}

dwóch pojemności cieplnych wynosi 1,4.
ciepło Q wymagane do doprowadzenia gazu z 300 do 600 K wynosi
Q = Δ h = N c P Δ T = 81.2438 × 29.1006 × 300 = 709 , 274 J {\displaystyle Q = {\Delta \ mathrm {H} } = n\, c_{p}\, \ Delta \ mathrm {T} = 81,2438 \ razy 29.1006\times 300=709,274{\text{ J}}}

.
wzrost energii wewnętrznej wynosi
Δ U = N c V Δ T = 81.2438 × 20.7862 × 300 = 506 , 625 J {\displaystyle \ Delta\u=n\, c_{v}\, \Delta\mathrm {T} =81.2438\razy 20.7862\razy 300=506,625 {\text{ J}}}

zatem, w = Q − Δ u = 202 , 649 J = N R Δ T {\displaystyle w=Q-\Delta U=202,649{\text{ J}}=nR\Delta \mathrm {T} }

również
W = P δ ν = 1 ATM × 2 m3 × 101325 pa = 202 , 650 j {\displaystyle w={p\Delta \nu }=1~{\text{ATM}}\times 2{\Text{m3}}\times 101325{\text{pa}}=202,650{\text{ j}}}

, co oczywiście jest identyczne z różnicą między ΔH i ΔU.
tutaj praca jest całkowicie pochłonięta ekspansją w stosunku do otoczenia . Z całego zastosowanego ciepła (709,3 kJ), wykonana praca (202,7 kJ) stanowi około 28,6% dostarczonego ciepła.

drugi przykład procesu jest podobny do pierwszego, z tą różnicą, że tłok bezmasowy zostaje zastąpiony przez tłok o masie 10,332.2 kg, co podwaja ciśnienie gazu butli do 2 atm. Objętość gazu w butli wynosi wówczas 1 m3 przy początkowej temperaturze 300 K. Ciepło jest dodawane powoli, aż temperatura gazu będzie równomiernie 600 K, po czym objętość gazu wynosi 2 m3, a tłok znajduje się 1 m powyżej swojego początkowego położenia. Jeśli ruch tłoka jest wystarczająco wolny, ciśnienie gazu w każdej chwili będzie miało praktycznie taką samą wartość (psys = 2 atm) w całym procesie.
ponieważ entalpia i energia wewnętrzna są niezależne od ciśnienia,
Q = Δ H = 709 , 274 J {\displaystyle Q={\Delta \mathrm {H} }=709,274{\text{ J}}}

i δ u = 506,625 j {\displaystyle \Delta u=506,625{\text{ J}}}

. W = P Δ V = 2 atm × 1 m3 × 101325 Pa = 202 , 650 J {\displaystyle W={P\Delta V}=2~{\text{atm}}\times 1~{\text{M3}}\times 101325{\text{Pa}}=202,650{\text{ J}}}

tak jak w pierwszym przykładzie, około 28,6% dostarczonego ciepła jest przekształcane do pracy. Ale tutaj praca jest stosowana na dwa różne sposoby: częściowo przez rozszerzanie otaczającej atmosfery, a częściowo przez podnoszenie 10,332. 2 kg na odległość h 1 m.
W l I f T = 10 332,2 kg × 9.80665 m / s2 × 1 m = 101, 324 J {\displaystyle W_{\RM {lift}}=10\,332.2~{\tekst{kg}} \ times 9.80665~{\text {m / s2}} \ times 1 {\text {m}}=101,324 {\text {J}}}

tak więc połowa pracy podnosi masę tłoka (praca grawitacji lub praca „użyteczna”), podczas gdy druga połowa rozszerza otoczenie.
wyniki tych dwóch przykładów procesów ilustrują różnicę między ułamkiem ciepła zamienionego na pracę użytkową (mgΔh) vs. frakcja przekształcona w pracę ciśnieniowo-objętościową wykonywaną w stosunku do otaczającej atmosfery. Praca użytkowa zbliża się do zera, gdy ciśnienie gazu roboczego zbliża się do ciśnienia otoczenia, podczas gdy maksymalna praca użytkowa jest uzyskiwana, gdy nie ma ciśnienia gazu otaczającego. Stosunek wszystkich wykonanych prac do ciepła wejściowego dla idealnej izobarycznej ekspansji gazu wynosi
W Q = N R Δ T N c P Δ T = 2 5 {\displaystyle {\frac {w}{Q}}={\frac {nR\Delta \mathrm {T} }{nc_{p}\Delta \mathrm {T} }}={\frac {2}{5}}}
