mechanizmy katalizy enzymatycznej
Wiązanie substratu z miejscem aktywnym enzymu jest bardzo specyficzną interakcją. Aktywnymi miejscami są rozszczepy lub rowki na powierzchni enzymu, zwykle złożone z aminokwasów z różnych części łańcucha polipeptydowego, które są połączone w trzeciorzędową strukturę złożonego białka. Substraty początkowo wiążą się z miejscem aktywnym przez interakcje niekowalencyjne, w tym wiązania wodorowe, wiązania jonowe i interakcje hydrofobowe. Gdy substrat jest związany z aktywnym miejscem enzymu, wiele mechanizmów może przyspieszyć jego konwersję do produktu reakcji.
chociaż prosty przykład omówiony w poprzedniej sekcji dotyczył tylko jednej cząsteczki substratu, większość reakcji biochemicznych obejmuje interakcje między dwoma lub więcej różnymi substratami. Na przykład tworzenie wiązania peptydowego polega na połączeniu dwóch aminokwasów. Dla takich reakcji wiązanie dwóch lub więcej substratów z miejscem aktywnym we właściwym położeniu i orientacji przyspiesza reakcję(Fig. 2.23). Enzym zapewnia szablon, na którym reagenty są połączone i odpowiednio zorientowane, aby sprzyjać tworzeniu stanu przejściowego, w którym wchodzą w interakcje.

rysunek 2.23
Kataliza enzymatyczna reakcji między dwoma substratami. Enzym zapewnia szablon, na którym dwa substraty są połączone w odpowiedniej pozycji i orientacji, aby reagować ze sobą.
enzymy przyspieszają reakcje również poprzez zmianę konformacji ich substratów do stanu przejściowego. Najprostszym modelem interakcji enzymu z substratem jest model blokady i klucza, w którym substrat dokładnie dopasowuje się do miejsca aktywnego (rysunek 2.24). W wielu przypadkach konfiguracje zarówno enzymu, jak i substratu są modyfikowane przez wiązanie substratów—proces zwany pasowaniem indukowanym. W takich przypadkach konformacja substratu jest zmieniana tak, że bardziej przypomina stan przejściowy. Naprężenie wytwarzane przez takie zniekształcenie podłoża może dodatkowo ułatwić jego konwersję do stanu przejściowego poprzez osłabienie wiązań krytycznych. Co więcej, stan przejściowy jest stabilizowany przez jego ścisłe wiązanie z enzymem, obniżając w ten sposób wymaganą energię aktywacji.

rysunek 2.24
modele interakcji enzymu z substratem. A) w modelu lock-and-key substrat dokładnie dopasowuje się do aktywnego miejsca enzymu. B) w modelu indukowanego dopasowania Wiązanie substratu zakłóca konformacje zarówno substratu, jak i enzymu. To zniekształcenie (więcej…)
oprócz łączenia wielu substratów i zniekształcania konformacji substratów w celu zbliżenia się do stanu przejściowego, wiele enzymów uczestniczy bezpośrednio w procesie katalitycznym. W takich przypadkach specyficzne łańcuchy boczne aminokwasów w miejscu aktywnym mogą reagować z substratem i tworzyć wiązania z pośrednimi reakcjami. Aminokwasy kwasowe i zasadowe są często zaangażowane w te mechanizmy katalityczne, co zilustrowano w poniższej dyskusji na temat chymotrypsyny jako przykład katalizy enzymatycznej.
chymotrypsyna należy do rodziny enzymów (proteaz serynowych), które trawią białka poprzez katalizowanie hydrolizy wiązań peptydowych. Reakcję można zapisać w następujący sposób:

różni członkowie rodziny proteaz serynowych (w tym chymotrypsyna, trypsyna, elastaza i trombina) mają różne specyfiki substratów; preferencyjnie rozszczepiają wiązania peptydowe przylegające do różnych aminokwasów. Na przykład, podczas gdy chymotrypsyna trawi wiązania sąsiadujące z aminokwasami hydrofobowymi, takimi jak tryptofan i fenyloalanina, trypsyna trawi wiązania sąsiadujące z aminokwasami zasadowymi, takimi jak lizyna i arginina. Wszystkie proteazy serynowe mają jednak podobną strukturę i wykorzystują ten sam mechanizm katalizy. Aktywne miejsca tych enzymów zawierają trzy krytyczne aminokwasy-serynę, histydynę i asparaginian—które napędzają hydrolizę wiązania peptydowego. Rzeczywiście, enzymy te nazywane są proteazami serynowymi ze względu na centralną rolę reszty serynowej.
substraty wiążą się z proteazami serynowymi poprzez wprowadzenie aminokwasu przylegającego do miejsca rozszczepiania do kieszeni w miejscu aktywnym enzymu (Fig.2.25). Charakter tej kieszonki determinuje specyficzność substratową poszczególnych członków rodziny proteaz serynowych. Na przykład kieszeń wiążąca chymotrypsyny zawiera hydrofobowe aminokwasy, które oddziałują z hydrofobowymi łańcuchami bocznymi jej preferowanych substratów. Natomiast kieszeń wiążąca trypsyny zawiera Ujemnie naładowany kwasowy aminokwas (asparaginian), który jest w stanie tworzyć wiązanie jonowe z resztami lizyny lub argininy jej substratów.
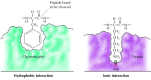
rysunek 2.25
Wiązanie substratów przez proteazy serynowe. Aminokwas przylegający do wiązania peptydowego, które ma zostać rozszczepione, jest wprowadzany do kieszeni w miejscu aktywnym enzymu. W chymotrypsynie kieszeń wiąże aminokwasy hydrofobowe; kieszeń wiążąca trypsyny zawiera (więcej…)
Wiązanie Substratowe pozycjonuje wiązanie peptydowe, które ma być rozszczepione w sąsiedztwie seryny w miejscu aktywnym (Fig.2.26). Proton tej seryny jest następnie przenoszony do miejsca aktywnego histydyny. Konformacja miejsca aktywnego sprzyja przenoszeniu protonów, ponieważ histydyna oddziałuje z ujemnie naładowaną pozostałością asparaginianową. Seryna reaguje z substratem, tworząc czworościanowy stan przejściowy. Wiązanie peptydowe jest następnie rozszczepiane, A C-końcowa część substratu jest uwalniana z enzymu. Jednak N-końcowy peptyd pozostaje związany z seryną. Sytuacja ta rozwiązuje się, gdy cząsteczka wody (drugi substrat) wchodzi do miejsca aktywnego i odwraca poprzednie reakcje. Proton cząsteczki wody jest przenoszony do histydyny, a jej grupa hydroksylowa jest przenoszona do peptydu, tworząc drugi czworościanowy stan przejściowy. Proton jest następnie przenoszony z histydyny z powrotem do seryny, a peptyd jest uwalniany z enzymu, kończąc reakcję.

rysunek 2.26
Mechanizm katalityczny chymotrypsyny. Trzy aminokwasy w miejscu aktywnym (Ser-195, his-57 i Asp-102) odgrywają kluczową rolę w katalizie.
Ten przykład ilustruje kilka cech katalizy enzymatycznej; specyficzność interakcji enzym-substrat, pozycjonowanie różnych cząsteczek substratu w miejscu aktywnym i udział reszt miejsca aktywnego w tworzeniu i stabilizacji stanu przejściowego. Chociaż tysiące enzymów w komórkach katalizuje wiele różnych rodzajów reakcji chemicznych, te same podstawowe zasady mają zastosowanie do ich działania.