Aquecimento Curvas
Figura \(\PageIndex{3}\) mostra uma curva de aquecimento, um gráfico de temperatura versus tempo de aquecimento, para 75 g de amostra de água. A amostra é inicialmente gelo a 1 atm e -23 ° C; como o calor é adicionado, a temperatura do gelo aumenta linearmente com o tempo. O declive da linha depende tanto da massa do gelo quanto do calor específico (Cs) do gelo, que é o número de joules necessários para elevar a temperatura de 1 g de gelo em 1 ° C. À medida que a temperatura do gelo aumenta, as moléculas de água no cristal de gelo absorvem cada vez mais energia e vibram mais vigorosamente. No ponto de fusão, eles têm energia cinética suficiente para superar forças atrativas e mover-se em relação um ao outro. À medida que mais calor é adicionado, a temperatura do sistema não aumenta mais, mas permanece constante a 0°C até que todo o gelo tenha derretido. Uma vez que todo o gelo foi convertido em água líquida, a temperatura da água começa novamente a aumentar. Agora, no entanto, a temperatura aumenta mais lentamente do que antes, porque a capacidade térmica específica da água é maior do que a do gelo. Quando a temperatura da água atinge 100 ° C, a água começa a ferver. Aqui, também, a temperatura permanece constante a 100 ° C até que toda a água tenha sido convertida em vapor. Neste ponto, a temperatura começa novamente a subir, mas a uma taxa mais rápida do que a observada nas outras fases, porque a capacidade de calor do vapor é menor do que a do gelo ou da água.
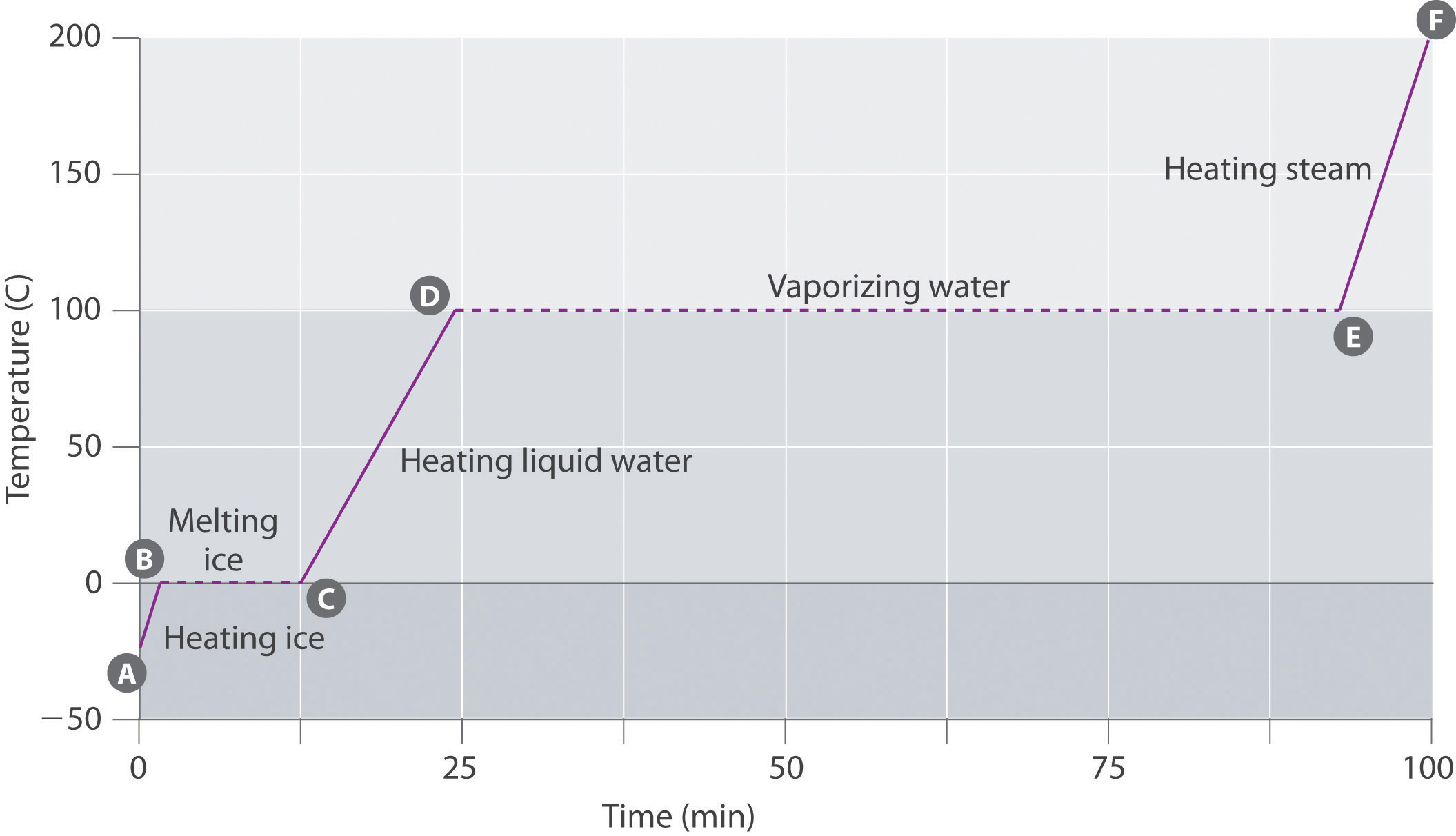
assim, a temperatura de um sistema não muda durante uma mudança de fase. Neste exemplo, contanto que mesmo uma pequena quantidade de gelo, a temperatura do sistema permanece a 0°C durante o processo de fusão, e contanto que mesmo uma pequena quantidade de água em estado líquido, a temperatura do sistema permanece a 100°C durante o processo de ebulição. A velocidade a que o calor é adicionado não afeta a temperatura da mistura gelo/água ou água/vapor porque o calor adicionado está sendo usado exclusivamente para superar as forças atrativas que mantêm a fase mais condensada juntos. Muitos cozinheiros pensam que a comida vai cozinhar mais rápido se o calor é elevado para que a água ferve mais rapidamente. Em vez disso, o pote da água ferverá à secura mais cedo, mas a temperatura da água não depende de quão vigorosamente ferve.
a temperatura de uma amostra não se altera durante uma alteração de fase.
Se o calor é adicionado a uma taxa constante, como na Figura \(\PageIndex{3}\), então o comprimento das linhas horizontais, que representa o tempo durante o qual a temperatura não muda, é diretamente proporcional à magnitude da as entalpias de associados com as mudanças de fase. Na figura \(\PageIndex{3}\), a linha horizontal a 100°C é muito maior do que a linha a 0°C porque a entalpia da vaporização da água é várias vezes maior do que a entalpia da fusão.um líquido sobreaquecido é uma amostra de um líquido à temperatura e pressão a que deve ser um gás. Líquidos superaquecidos não são estáveis; o líquido eventualmente ferve, às vezes violentamente. O fenômeno do superaquecimento causa “bumping” quando um líquido é aquecido no laboratório. Quando um tubo de ensaio contendo água é aquecido sobre um queimador Bunsen, por exemplo, uma porção do líquido pode facilmente tornar-se demasiado quente. Quando o líquido superaquecido converte-se em gás, ele pode empurrar ou “bater” o resto do líquido para fora do tubo de ensaio. Colocar uma vareta agitadora ou um pequeno pedaço de Cerâmica (um “chip fervente”) no tubo de ensaio permite a formação de bolhas de vapor na superfície do objeto, de modo que o líquido ferve em vez de ficar superaquecido. Superaquecimento é a razão pela qual um líquido aquecido num copo liso num forno de microondas não pode ferver até que o copo seja movido, quando o movimento do copo permite a formação de bolhas.