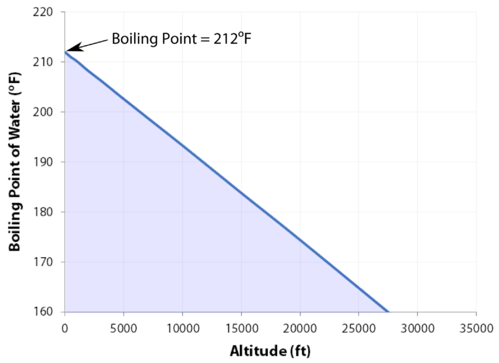
Ponto de Ebulição
Como um líquido é aquecido, a média da energia cinética das partículas aumenta. A taxa de evaporação aumenta à medida que mais e mais moléculas são capazes de escapar da superfície do líquido para a fase vapor. Eventualmente, um ponto é alcançado quando as moléculas em todo o líquido têm energia cinética suficiente para vaporizar. Neste ponto, o líquido começa a ferver. O ponto de ebulição é a temperatura a que a pressão de vapor de um líquido é igual à pressão externa. A figura abaixo ilustra a ebulição do líquido.
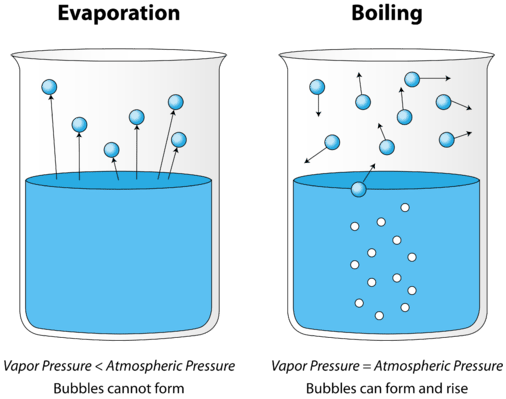
na figura à esquerda, o líquido está abaixo do seu ponto de ebulição, ainda que alguns dos evaporados líquidos. À direita, a temperatura foi aumentada até que as bolhas comecem a formar-se no corpo do líquido. Quando a pressão de vapor dentro da bolha é igual à pressão atmosférica externa, as bolhas sobem para a superfície do líquido e rebentam. A temperatura a que este processo ocorre é o ponto de ebulição do líquido.
O ponto de ebulição normal é a temperatura a que a pressão de vapor do líquido é igual à pressão padrão. Como a pressão atmosférica pode mudar com base na localização, o ponto de ebulição de um líquido muda com a pressão externa. O ponto de ebulição normal é uma constante, uma vez que é definida em relação à pressão atmosférica padrão de \(760 \: \text{mm} \: \ce{Hg}\) ou \(1 \: \text{atm}\) ou \(101.3 \: \text{kPa}\)).