reações Redox são todos os cerca de elétrons transferidos de uma substância para outra, por isso, é útil ter um sistema para acompanhar o que ganha e o que perde elétrons, e quantos elétrons estão envolvidos. O sistema de registro de reações redox é chamado números de oxidação. Você também pode se lembrar de algo chamado eletronegatividade de aulas anteriores de química.
eletronegatividade
A capacidade de um átomo ligado atrair elétrons compartilhados para si mesmo.quando dois átomos de elementos diferentes estão ligados entre si por uma ligação covalente (compartilhando elétrons), os elétrons geralmente não são compartilhados igualmente entre os dois átomos devido a diferenças em suas eletronegatividades. Pensa nisto como um puxão de guerra para os electrões. Às vezes ambos os átomos puxam com a mesma força em elétrons compartilhados; outras vezes há claramente um jogador mais forte que vai puxar os elétrons mais perto de si mesmo.
considere a ligação entre um átomo de hidrogénio (com um electrão de Valência) e um átomo de oxigénio (com os seus seis electrões de Valência):
|
|
+
|
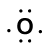 |
=
|
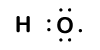 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to o átomo de hidrogénio. Esta não é a transferência total de elétrons que criaria um íon, mas cargas parciais formam-se. A extremidade de hidrogênio da ligação é parcialmente positiva (+1) porque ela perdeu um elétron parcialmente, e a extremidade de oxigênio do H-O é parcialmente negativa (-1) porque ela ganhou parcialmente o elétron a partir do hidrogênio.:
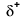 |
|
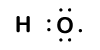 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
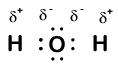
vemos que cada um dos dois hidrogénios perdeu um electrão para o oxigénio. O oxigênio “ganhou” dois elétrons-um de cada hidrogênio. Mais uma vez, estes não são iões verdadeiros, mas é útil pensar neles da mesma forma.
cargas dadas aos átomos em uma molécula desta forma são chamados números de oxidação. Nós podemos usar números de oxidação para manter o controle de onde os elétrons estão em uma molécula, e como eles se movem durante uma reação. Em nosso exemplo de água, hidrogênio é atribuído um número de oxidação de +1 porque cada hidrogênio individual tem “perdido” um elétron. Oxygen has an oxidation number of +2 because the single oxygen atom has “gained” a total of two electrons, one from each hydrogen.
Aqui está outra molécula envolvendo o hidrogênio e o oxigênio, peróxido de hidrogênio, H2O2:
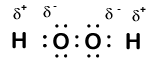
Em peróxido de hidrogênio, cada hidrogênio ainda tem um número de oxidação de +1, porque cada um de hidrogênio “dá” um único elétron do oxigênio. O oxigênio, no entanto, agora tem um número de oxidação de -1 porque cada oxigênio ganha apenas um elétron de seu hidrogênio vizinho. Os elétrons entre os dois átomos de oxigênio idênticos são compartilhados igualmente, de modo que não há carga parcial resultante dessa ligação.
Número de oxidação
um número positivo ou negativo atribuído a um átomo numa molécula ou íon que reflecte um ganho parcial ou perda de electrões.conhecer o número de oxidação de cada elemento individual de uma molécula será um passo fundamental na nossa compreensão das reacções redox. Felizmente, geralmente não envolve desenhar diagramas de pontos de elétrons. Em vez disso, há uma série de regras que podemos usar para determinar os números de oxidação. Aqui estão as principais regras:
| O número de oxidação de um elemento puro (por si só, e não um íon) é zero. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal à sua carga. metais alcalinos-elementos na primeira coluna da tabela periódica – terá sempre um número de oxidação de +1; metais alcalinos da Terra (coluna 2) são quase sempre +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
o número de oxidação do oxigênio é quase sempre -2 quando ele está em um composto.peróxidos, tais como peróxido de hidrogénio. Em peróxidos, o oxigênio tem um número de oxidação de -1.quando o oxigénio é combinado com flúor, o seu número de oxidação é +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
A soma dos números de oxidação de um composto é igual a zero. para determinar o número de oxidação de Mn em Mn2O7, temos de trabalhar para trás:
-2 × 7 átomos = -14 total Uma Vez Que a soma dos números de oxidação deve ser zero, o número total de oxidação de Mn deve ser +14 para cancelar o oxigênio -14, mas uma vez que existem 2 átomos de Mn, cada átomo individual terá um número de oxidação de +7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
a soma dos números de oxidação em um íon poliatômico é igual à carga sobre esse íon.mais uma vez, trabalhar para trás para determinar o número de oxidação de qualquer átomo não-oxigénio ou não-hidrogénio. Para determinar o número de oxidação do Cr em Cr2O72- :
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is importante notar que o número de oxidação sempre se refere a cada átomo individual no composto, não ao total para esse elemento.
Por exemplo, em H2O, a “carga” positiva total para ambos os átomos de hidrogênio será +2 (que se equilibra com o -2 do oxigênio), mas cada hidrogênio tem um número de oxidação de +1.
contribuições& atribuições
esta página foi construída a partir do conteúdo através do(s) seguinte (s) contribuinte (s) e editada (topicamente ou extensivamente) pela equipe de desenvolvimento LibreTexts para atender o estilo de plataforma, apresentação e qualidade:CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.