os Objectivos de Aprendizagem
- Usar celular de notação para descrever células galvânicas
- Descrever os componentes básicos de células galvânicas\
células Galvânicas, também conhecido como voltaica células são células eletroquímicas em que espontânea de oxidação-redução reacções de produzir energia elétrica. Por escrito as equações, é frequentemente conveniente separar as reações de oxidação-redução em meias-reações para facilitar o equilíbrio da equação global e enfatizar as transformações químicas reais.considere o que acontece quando um pedaço limpo de metal de cobre é colocado numa solução de nitrato de prata (figura \(\PageIndex{1}\)). Assim que o metal de cobre é adicionado, o metal de prata começa a se formar e íons de cobre passam para a solução. A cor Azul da solução à direita indica a presença de íons de cobre. A reacção pode ser dividida em duas meias-reacções. Half-reactions separate the oxidation from the reduction, so each can be considered individually.
a equação para A redução da meia-reação tinha que ser dobrado para que o número de elétrons “ganhou” na redução da meia-reação de igualar o número de elétrons “perdido” na oxidação de meia-reação.

células galvânicas ou voltaicas envolvem reações eletroquímicas espontâneas nas quais as meias-reações são separadas (figura \(\PageIndex{2}\)) de modo que a corrente possa fluir através de um fio externo. O copo do lado esquerdo da figura é chamado de meia célula, e contém uma solução de 1 M de nitrato de cobre(II) com um pedaço de metal de cobre parcialmente submerso na solução. O metal de cobre é um eletrodo. O cobre está passando por oxidação; portanto, o eletrodo de cobre é o ânodo. O ânodo é conectado a um voltímetro com um fio e o outro terminal do voltímetro é conectado a um eletrodo de prata por um fio. O Prata está passando por uma redução; portanto, o eletrodo de prata é o cátodo. A meia célula do lado direito da figura consiste no eléctrodo de prata numa solução de 1 M de nitrato de prata (AgNO3). Neste ponto, nenhum fluxo de corrente-ou seja, nenhum movimento significativo de elétrons através do fio ocorre porque o circuito está aberto. O circuito é fechado usando uma ponte de sal, que transmite a corrente com íons em movimento. A ponte salina consiste de uma solução eletrolítica concentrada, não reativa, como a solução de nitrato de sódio (NaNO3) utilizada neste exemplo. À medida que os electrões fluem da esquerda para a direita através do eléctrodo e do fio, os iões nitrato (aniões) passam através do tampão poroso da esquerda para a solução de nitrato de cobre(II). Isso mantém o copo à esquerda eletricamente neutro, neutralizando a carga sobre os íons de cobre (II) que são produzidos na solução como o metal de cobre é oxidado. Ao mesmo tempo, os íons de nitrato estão se movendo para a esquerda, íons de sódio (catiões) se movem para a direita, através do plug poroso, e para a solução de nitrato de prata à direita. Estes catiões adicionados “substituir” os iões de prata que são removidos da solução como eles foram reduzidos a metal de prata, mantendo o copo na direita eletricamente neutro. Sem a ponte de sal, os compartimentos não permaneceriam eletricamente neutros e nenhuma corrente significativa fluiria. No entanto, se os dois compartimentos estiverem em contacto directo, não é necessária uma ponte de sal. No instante em que o circuito é completado, o voltímetro lê +0,46 V, isto é chamado de potencial celular. O potencial celular é criado quando os dois metais diferentes são conectados, e é uma medida da energia por unidade de carga disponível a partir da reação de oxidação-redução. A volt é a unidade SI derivada para Potencial elétrico
\
nesta equação, A é a corrente em amperes e C a carga em coulombs. Note que os volts devem ser multiplicados pela carga em coulombs (C) para obter a energia em joules (J).
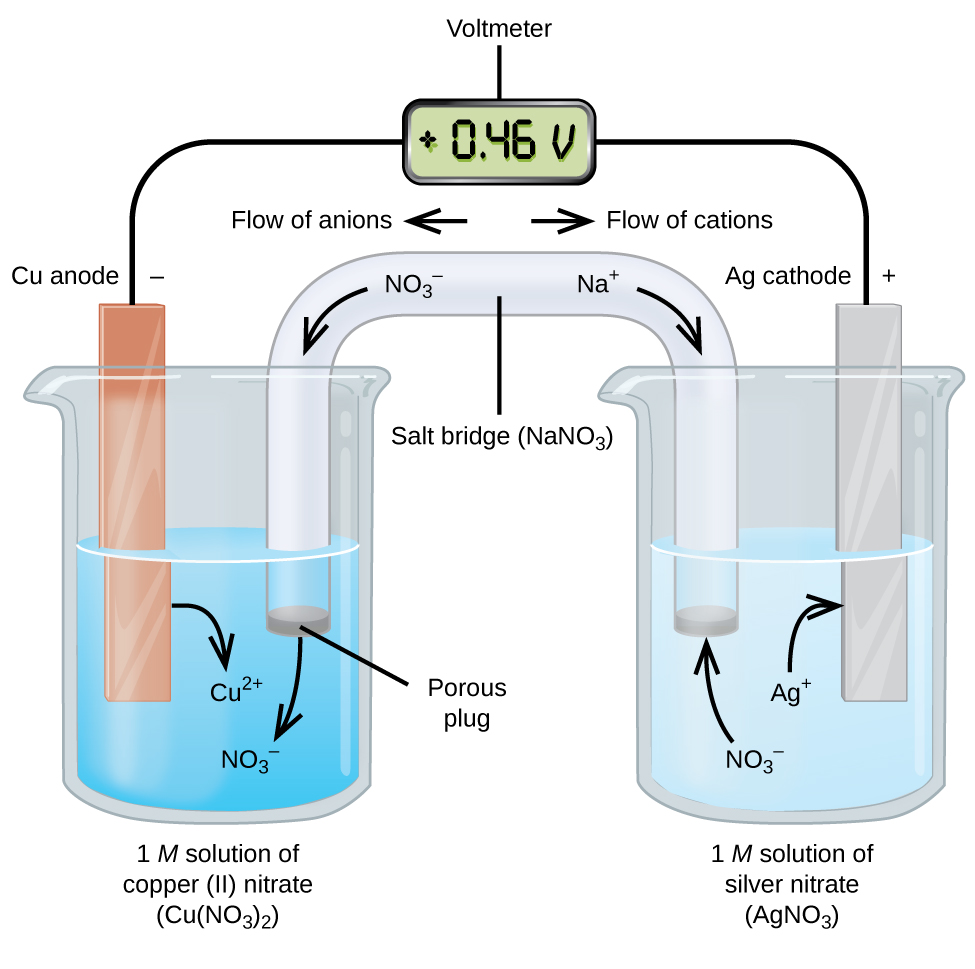
quando a célula electroquímica é construída desta forma, um potencial celular positivo indica uma reação espontânea e que os elétrons estão fluindo da esquerda para a direita. Há muita coisa acontecendo na figura \(\PageIndex{2}\), por isso é útil resumir as coisas para este sistema:
- os electrões fluem do ânodo para o cátodo: da esquerda para a direita na célula galvânica padrão na figura.
- o eletrodo na meia-célula esquerda é o ânodo porque a oxidação ocorre aqui. O nome refere-se ao fluxo de aniões na ponte de sal em direção a ele.
- o eletrodo na meia-célula direita é o cátodo porque a redução ocorre aqui. O nome refere-se ao fluxo de catiões na ponte de sal em direção a ela.
- oxidação ocorre no ânodo (a meia-célula esquerda na figura).
- ocorre redução no cátodo (a meia-célula direita na figura).
- o potencial celular, + 0,46 V, neste caso, resulta das diferenças inerentes na natureza dos materiais utilizados para fazer as duas meias-células.a ponte salina deve estar presente para fechar (completar) o circuito e tanto a oxidação como a redução devem ocorrer para a corrente fluir.
Existem muitas células galvânicas possíveis, por isso uma notação estenográfica é geralmente usada para descrevê-las. A notação celular (às vezes chamada de diagrama celular) fornece informações sobre as várias espécies envolvidas na reação. Esta notação também funciona para outros tipos de células. Uma linha vertical,│, denota um limite de fase e uma linha dupla,‖, a ponte de sal. Informações sobre o ânodo são escritas à esquerda, seguido pela solução do ânodo, em seguida, a ponte de sal (quando presente), em seguida, a solução do cátodo, e, finalmente, informações sobre o cátodo à direita. A notação celular para a célula galvânica na figura \(\PageIndex{2}\) é então
\
Note que os íons espectadores não estão incluídos e que a forma mais simples de cada meia-reacção foi usada. Quando conhecidas, as concentrações iniciais dos vários íons são geralmente incluídas.
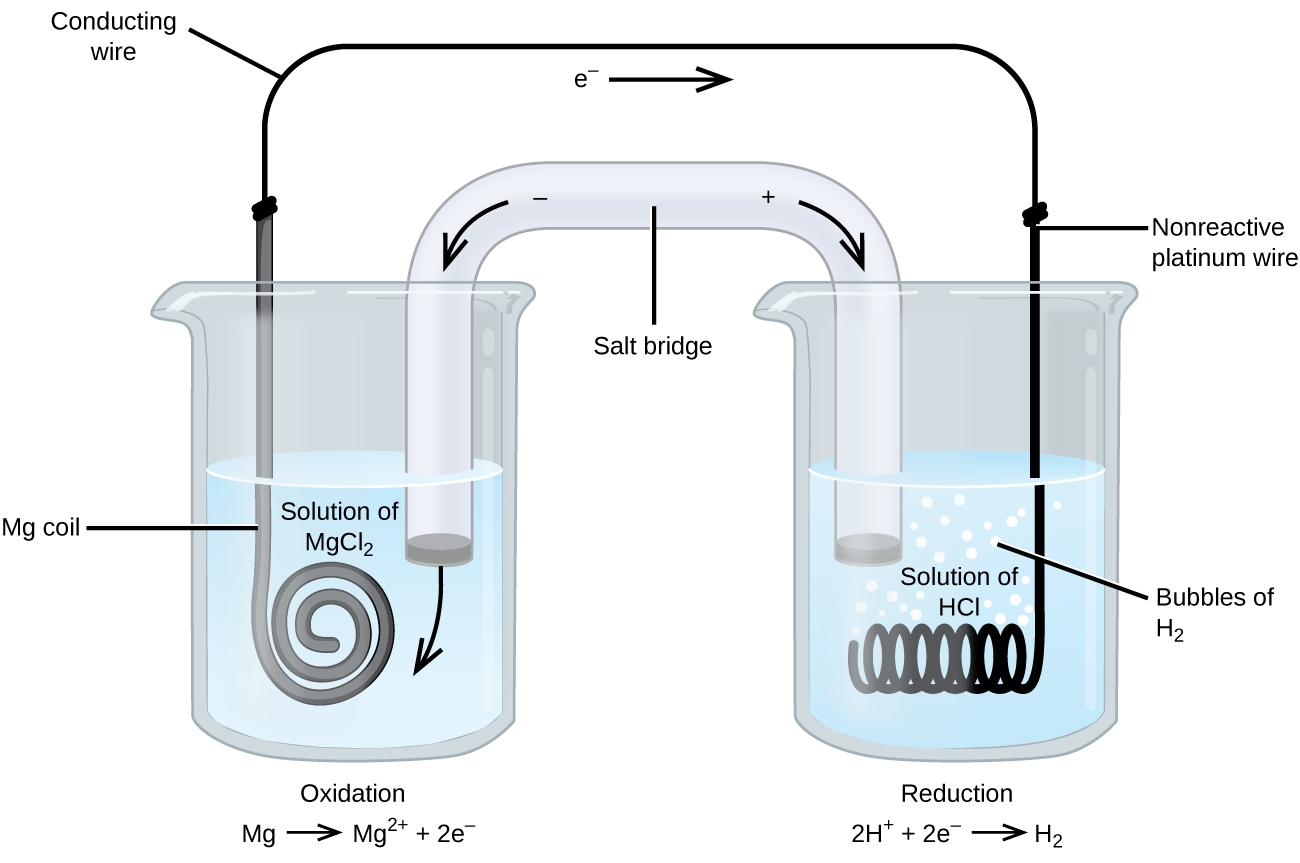
uma das células mais simples é a célula de Daniell. É possível construir esta bateria colocando um eletrodo de cobre no fundo de um jarro e cobrindo o metal com uma solução de sulfato de cobre. Uma solução de sulfato de zinco é flutuada sobre a solução de sulfato de cobre; em seguida, um eletrodo de zinco é colocado na solução de sulfato de zinco. Conectando o eletrodo de cobre ao eletrodo de zinco permite que uma corrente elétrica flua. Este é um exemplo de uma célula sem uma ponte de sal, e íons podem fluir através da interface entre as duas soluções.algumas reações de oxidação-redução envolvem espécies que são condutores pobres de eletricidade, e assim um eletrodo é usado que não participa das reações. Frequentemente, o eletrodo é platina, ouro ou grafite, todos inertes a muitas reações químicas. Um desses sistemas é mostrado na figura \(\PageIndex{3}\). O magnésio sofre oxidação no ânodo à esquerda na figura e os íons de hidrogênio sofrem redução no cátodo à direita. A reação pode ser resumida como
a célula usou um fio de platina inerte para o cátodo, de modo que a notação celular é
o eletrodo de magnésio é um eletrodo ativo porque participa na reação de oxidação-redução. Eléctrodos inertes, como o eléctrodo de platina na figura \(\PageIndex{3}\), não participam na reacção de oxidação-redução e estão presentes para que a corrente possa fluir através da célula. Platinum or gold generally make good inert electrodes because they are chemically unreactive.
exemplo \(\PageIndex{1}\): Usando a notação celular
considere uma célula galvânica constituída por
\
escreva as semi-reacções de oxidação e redução e escreva a reacção utilizando a notação celular. Que reacção ocorre no ânodo? O cátodo?
solução
Por inspeção, Cr é oxidado quando três elétrons são perdidos para formar Cr3+, e Cu2+ é reduzido à medida que ganha dois elétrons para formar Cu. Balancear a carga dá
\
Notação celular usa a forma mais simples de cada uma das equações, e começa com a reação no ânodo. Não foram especificadas concentrações assim:
\
oxidação ocorre no ânodo e redução no cátodo.
exemplo \(\PageIndex{2}\): Usando a notação celular
considere uma célula galvânica constituída por
escreva as semi-reacções de oxidação e redução e escreva a reacção utilizando a notação celular. Que reacção ocorre no ânodo? O cátodo?
solução
Por inspeção, Fe2+ sofre oxidação quando um elétron é perdido para formar Fe3+, e MnO4− é reduzido à medida que ganha cinco elétrons para formar Mn2+. Balancear a carga dá
\
Notação celular usa a forma mais simples de cada uma das equações, e começa com a reação no ânodo. É necessário usar um eletrodo inerte, como a platina, porque não há metal presente para conduzir os elétrons do ânodo para o cátodo. Não foram especificadas concentrações assim:
\
oxidação ocorre no ânodo e redução no cátodo.
exercício \(\PageIndex{1}\)
utilize a notação celular para descrever a célula galvânica em que os iões de cobre(II) são reduzidos a metal de cobre e o metal de zinco é oxidado a iões de zinco.
Resposta
da informação dada no problema:
\
Usando a notação celular:
\
resumo
células electroquímicas consistem tipicamente em duas meias-células. As meias-células separam a meia-reacção de oxidação da meia-reacção de redução e tornam possível a corrente fluir através de um fio externo. Uma meia-célula, normalmente representada no lado esquerdo de uma figura, contém o ânodo. A oxidação ocorre no ânodo. O ânodo é conectado ao cátodo na outra meia-célula, muitas vezes mostrado no lado direito em uma figura. A redução ocorre no cátodo. A adição de uma ponte de sal completa o circuito permitindo a corrente fluir. Aniões na ponte de sal fluem em direção ao ânodo e catiões na ponte de sal fluem em direção ao cátodo. O movimento destes íons completa o circuito e mantém cada meia célula eletricamente neutra. Células eletroquímicas podem ser descritas usando notação celular. Nesta Notação, informações sobre a reação no ânodo aparecem à esquerda e informações sobre a reação no cátodo à direita. A ponte salt é representada por uma linha dupla,‖. As fases sólidas, líquidas ou aquosas dentro de uma meia-célula são separadas por uma única linha, │. A fase e concentração das várias espécies é incluída após o nome da espécie. Eletrodos que participam da reação de oxidação-redução são chamados eletrodos ativos. Eletrodos que não participam da reação de oxidação-redução, mas existem para permitir o fluxo de corrente são eletrodos inertes. Eletrodos inertes são muitas vezes feitos de platina ou ouro, que são inalterados por muitas reações químicas.
glossário
eléctrodo activo que participa na reacção de oxidação-redução de uma célula electroquímica; a massa de um eléctrodo activo muda durante a reacção de oxidação-redução do eléctrodo anódico numa célula electroquímica na qual ocorre oxidação; informações sobre o ânodo está gravado no lado esquerdo do sal ponte na célula notação cátodo eletrodo em uma célula eletroquímica na qual a redução ocorre; informações sobre o cátodo está gravado no lado direito do sal ponte na célula notação célula notação abreviada de forma a representar as reações em uma célula eletroquímica da célula diferença de potencial elétrica, potencial que surge quando metais diferentes estão ligado; a força motriz para o fluxo de carga (corrente) em reações de oxidação e redução galvânica célula célula eletroquímica que envolve uma oxidação espontânea-reação de redução; células eletroquímicas com celular positiva potenciais; também chamado de célula voltaica inerte eletrodo eletrodo que permite o fluxo de corrente, mas que não participar de oxidação e redução, reação em uma célula eletroquímica; a massa de um eletrodo inerte não se altere durante o processo de oxidação-redução, reação de; eletrodos inertes são muitas vezes feitos de platina ou ouro porque estes metais são quimicamente não reativos. célula voltaica outro nome para uma célula galvânica
Colaboradores e Atribuições
-
Paulo Flores (Universidade da Carolina do Norte – Pembroke), Klaus Theopold (Universidade de Delaware (eua) e Richard Langley (Stephen F. Austin State University), com autores. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download gratuito em http://cnx.org/contents/85abf193-2bd…[email protected]).