Seguinte: 3.4 Frigoríficos e Calor Até: 3. A primeira lei anterior: 3.2 A representação generalizada do Índice de conteúdos
um ciclo de Carnot é mostrada na figura 3.4. Tem quatro processos. Existem duas pernas adiabáticas reversíveis e duas pernas reversíveis. Podemos construir um ciclo Carnot com muitos sistemas diferentes, mas os conceitos podem ser mostrados usando um fluido de trabalho familiar, o gás ideal. O sistema pode ser considerado como uma câmara fechada por um pistão e cheia com este gás ideal.
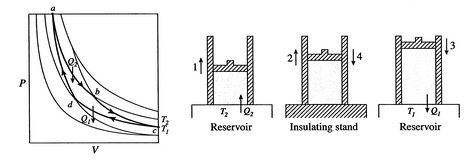
Os quatro processos no ciclo de Carnot são:
- O sistema está na temperatura
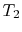 estado
estado  . É trabalhada em contacto com um reservatório de calor, que é apenas um líquido ou uma massa sólida de uma extensão suficientemente grande para que a sua temperatura não mude de forma apreciável quando alguma quantidade de calor é transferida para o sistema. Em outras palavras, o reservatório de calor é uma constante temperaturesource (ou receptor) de calor. O sistema então passa por expansão anisotérmica de
. É trabalhada em contacto com um reservatório de calor, que é apenas um líquido ou uma massa sólida de uma extensão suficientemente grande para que a sua temperatura não mude de forma apreciável quando alguma quantidade de calor é transferida para o sistema. Em outras palavras, o reservatório de calor é uma constante temperaturesource (ou receptor) de calor. O sistema então passa por expansão anisotérmica de  para
para  , com calor absorvido
, com calor absorvido 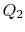 .
. - Atstate
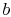 , o sistema é termicamente isolado (removido do contato com o reservatório de calor) e, em seguida, deixe expandir para
, o sistema é termicamente isolado (removido do contato com o reservatório de calor) e, em seguida, deixe expandir para 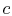 . Durante esta expansão, a temperatura diminui para
. Durante esta expansão, a temperatura diminui para 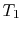 . O calor trocado durante esta parte do ciclo,
. O calor trocado durante esta parte do ciclo, 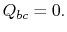 )
) - no estado
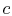 o sistema está em contacto com um reservatório de calor à temperatura
o sistema está em contacto com um reservatório de calor à temperatura 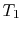 . It isthen compressed to state
. It isthen compressed to state 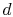 , rejecting heat
, rejecting heat 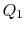 in the process.finalmente, o sistema é comprimido adiabaticamente de volta ao estado inicial
in the process.finalmente, o sistema é comprimido adiabaticamente de volta ao estado inicial  . The heat exchange
. The heat exchange 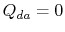 .
.
A eficiência térmica do ciclo é dado pela definição
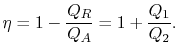 |
(3..4) |
nesta equação, há uma convenção de sinais implícita. As quantidades![]()
![]() como definidas são as magnitudes do calor absorvido e expulso. As quantidades
como definidas são as magnitudes do calor absorvido e expulso. As quantidades ![]()
![]() por outro lado, são definedwith referência ao calor recebido pelo sistema. Neste exemplo, oformador é negativo e o último é positivo. O calor absorvido e expulso pelo sistema ocorre durante os processos isotérmicos e já sabemos quais são os seus valores de Eq.(3.1):
por outro lado, são definedwith referência ao calor recebido pelo sistema. Neste exemplo, oformador é negativo e o último é positivo. O calor absorvido e expulso pelo sistema ocorre durante os processos isotérmicos e já sabemos quais são os seus valores de Eq.(3.1):
Theefficiency agora pode ser escrito em termos dos volumes thedifferent estados como
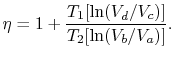 |
(3..5) |
The path from states ![]() to
to ![]() and from
and from ![]() to
to ![]() are bothadiabatic and reversible. For a reversible adiabatic process we knowthat
are bothadiabatic and reversible. For a reversible adiabatic process we knowthat ![]() . Using the ideal gas equation ofstate, we have
. Using the ideal gas equation ofstate, we have ![]() . Along curve
. Along curve![]()
![]() , therefore,
, therefore, ![]() . Alongthe curve
. Alongthe curve ![]()
![]()
![]() . Thus,
. Thus,

Comparing the expression for thermal efficiencyEq. (3.4) with Eq. (3.5) mostrar duas consequências. Primeiro, os calores recebidos e rejeitados estão relacionadas as temperaturas da isotérmica partes do ciclo
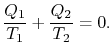 |
(3..6) |
em Segundo lugar, a eficiência de um ciclo de Carnot é dada de forma compacta por
 |
(3..7) |
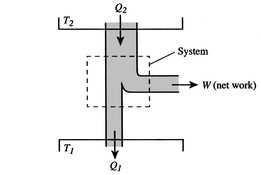
a eficiência só pode ser 100% se a temperatura a que o aquecimento é rejeitado for zero. As transferências de calor e de trabalho de e para o sistema são apresentadas esquematicamente no quadro 3.5.
Enlameado Pontos
Desde ![]() olhando para o
olhando para o ![]()
![]() gráfico, doesthat significa o mais distante
gráfico, doesthat significa o mais distante ![]()
![]() isotérmicas são, thegreater eficiência? E que se eles fossem muito próximos, seria muito ineficiente? (MP 3.2)
isotérmicas são, thegreater eficiência? E que se eles fossem muito próximos, seria muito ineficiente? (MP 3.2)
no ciclo de Carnot, por que estamos a lidar apenas com alterações de volume e não com alterações de pressão nas adiabatas e isotérmicas?(MP 3.3)
Existe uma aplicação física para o ciclo de Carnot? Podemos conceber um motor Carnot para um dispositivo de propulsão?(MP 3.4)
Como sabemos que ciclos usar como modelos para processos reais?(MP 3.5)
Seguinte: 3.4 Frigoríficos e Calor Até: 3. A Primeira Lei Anterior: 3.2 representação generalizada do Índice
UnifiedTP