a Lei de Várias Proporções
uma Vez a ideia de que a combinação dos elementos em definitivo proporções para formar compostos foi estabelecido, experiências também começou a demonstrar que os mesmos pares de certos elementos podem se combinar para formar mais de um composto. Considere os elementos carbono e oxigênio. Combinados de uma maneira, formam o composto familiar chamado dióxido de carbono. Em cada amostra de dióxido de carbono, há \(32.0 \: \text{g}\) de oxigênio presente para cada \(12.0 \: \text{g}\) de carbono. Dividindo \(32.0\) por \(12.0\), isto simplifica para uma razão de massa de oxigênio para carbono de 2,66 para 1. Há outro composto que se forma a partir da combinação de carbono e oxigênio chamado monóxido de carbono. Cada amostra de monóxido de carbono contém \(16, 0 \: \text{g}\) de oxigénio para cada \(12, 0 \: \text{g}\) de carbono. Esta é uma razão de massa de oxigênio para carbono de 1,33 para 1. No dióxido de carbono, há exatamente o dobro de oxigênio presente como há no monóxido de carbono. Este exemplo ilustra a lei de proporções múltiplas: sempre que os mesmos dois elementos formam mais de um composto, as massas diferentes de um elemento que se combinam com a mesma massa do outro elemento estão na razão de pequenos números inteiros.
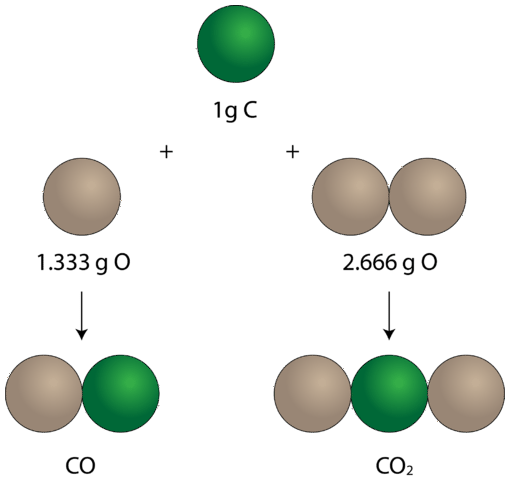
Em monóxido de carbono, à esquerda, existe \(1.333 \: \text{g}\) de oxigênio para cada \(1 \: \text{g}\) de carbono. No dióxido de carbono, à direita, há \(2.666 \: \texto{g}\) de oxigênio para cada grama de carbono. Assim, a proporção de oxigênio nos dois compostos é de 1:2, uma pequena proporção de números inteiros.a diferença entre o monóxido de carbono e o dióxido de carbono é significativa. Monóxido de carbono é um gás mortal, formado a partir da combustão incompleta de alguns materiais contendo carbono (como madeira e gasolina). Este composto irá ligar-se à hemoglobina nos glóbulos vermelhos e bloquear a ligação do oxigénio a essas células. Se o oxigênio não se liga, ele não pode ser transportado para as células do corpo onde é necessário, e a morte pode ocorrer. O dióxido de carbono, por outro lado, não é tóxico como o monóxido de carbono é. No entanto, ele pode deslocar oxigênio em sistemas uma vez que é mais pesado. Os extintores de dióxido de carbono cortam o fluxo de oxigênio em um incêndio, apagando o fogo.