Mecanismos de Catálise Enzimática
A ligação do substrato ao sítio ativo de uma enzima é um tipo muito específico de interação. Os locais activos são fissuras ou ranhuras na superfície de uma enzima, normalmente composta por aminoácidos de diferentes partes da cadeia polipeptídica que são reunidas na estrutura terciária da proteína dobrada. Substratos ligam-se inicialmente ao local ativo por interações não-afetivas, incluindo ligações de hidrogênio, ligações iônicas e interações hidrofóbicas. Uma vez que um substrato Está ligado ao local ativo de uma enzima, múltiplos mecanismos podem acelerar a sua conversão ao produto da reação.embora o exemplo simples discutido na secção anterior envolvesse apenas uma única molécula de substrato, a maioria das reacções bioquímicas envolvem interacções entre dois ou mais substratos diferentes. Por exemplo, a formação de uma ligação peptídica envolve a junção de dois aminoácidos. Para estas reacções, a ligação de dois ou mais substratos ao local activo na posição e orientação adequadas acelera a reacção (figura 2.23). A enzima fornece um modelo sobre o qual os reagentes são reunidos e devidamente orientados para favorecer a formação do Estado de transição em que interagem.


figura 2.24
modelos de interacção enzima-substrato. A) no modelo lock-and-key, o substrato encaixa-se precisamente no local activo da enzima. B) no modelo de encaixe induzido, a ligação ao substrato distorce as conformações do substrato e da enzima. Esta distorção (mais…)
além de trazer vários substratos em conjunto e distorcendo a conformação de substratos para a aproximação ao estado de transição, muitas enzimas participam diretamente no processo catalítico. Nesses casos, cadeias laterais específicas de aminoácidos no local activo podem reagir com o substrato e formar ligações com intermediários de reacção. Os aminoácidos ácidos e básicos estão frequentemente envolvidos nestes mecanismos catalíticos, como ilustrado na discussão seguinte da quimotripsina como um exemplo de catálise enzimática.a quimotripsina é um membro de uma família de enzimas (proteases serinas) que digerem proteínas catalisando a hidrólise de ligações peptídicas. A reação pode ser escrita da seguinte forma:

os diferentes membros da família das proteases serinas (incluindo quimotripsina, tripsina, elastase e trombina) têm características específicas do substrato.; eles preferencialmente clivem ligações peptídicas adjacentes a diferentes aminoácidos. Por exemplo, enquanto a quimotripsina digere ligações adjacentes a aminoácidos hidrofóbicos, tais como triptofano e fenilalanina, tripsina digere ligações próximas a aminoácidos básicos, tais como lisina e arginina. Todas as proteases serinas, no entanto, são similares na estrutura e usam o mesmo mecanismo de catálise. Os locais activos destas enzimas contêm três aminoácidos críticos-serina, histidina e aspartato—que conduzem a hidrólise da ligação peptídica. Na verdade, estas enzimas são chamadas proteases serinas por causa do papel central do resíduo serina.os substratos ligam-se às proteases da serina através da inserção do aminoácido adjacente ao local de clivagem num buraco no local activo da enzima (figura 2.25). A natureza deste bolso determina a especificidade do substrato dos diferentes membros da família das proteases serinas. Por exemplo, a bolsa de ligação de quimotripsina contém aminoácidos hidrofóbicos que interagem com as cadeias laterais hidrofóbicas dos seus substratos preferidos. Em contraste, a bolsa de ligação de tripsina contém um aminoácido ácido negativamente carregado (aspartato), que é capaz de formar uma ligação iônica com os resíduos de lisina ou arginina de seus substratos.
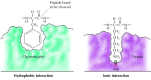
figura 2.25
ligação do substrato pelas proteases serinas. O aminoácido adjacente à ligação peptídica a clivar é inserido num buraco no local activo da enzima. Na quimotripsina, a bolsa liga-se aos aminoácidos hidrofóbicos; a bolsa de ligação da tripsina contém (mais…)
Substrate binding positions the peptide bond to be clived adjacent to the active site serine (Figure 2.26). O protão desta serina é então transferido para o local activo histidina. A conformação do local ativo favorece esta transferência de prótons porque o histidina interage com o resíduo de aspartato carregado negativamente. A serina reage com o substrato, formando um estado de transição tetraédrico. A ligação peptídica é então clivada e a porção C-terminal do substrato é libertada da enzima. No entanto, o peptídeo N-terminal permanece ligado à serina. Esta situação resolve-se quando uma molécula de água (o segundo substrato) entra no local activo e inverte as reacções anteriores. O próton da molécula de água é transferido para histidina, e seu grupo hidroxilo é transferido para o péptido, formando um segundo estado de transição tetraédrica. O protão é então transferido da histidina de volta para a serina, e o peptídeo é libertado da enzima, completando a reacção.

figura 2.26
mecanismo catalítico da quimotripsina. Três aminoácidos no local ativo (Ser-195, His-57 e Asp-102) desempenham papéis críticos na catálise.
Este exemplo ilustra várias características de catálise enzimática; a especificidade da enzima-substrato medicamentosas, o posicionamento de diferentes moléculas de substrato no sítio ativo, e o envolvimento de ativos-site de resíduos na formação e estabilização do estado de transição. Embora os milhares de enzimas em células catalisem muitos tipos diferentes de reações químicas, os mesmos princípios básicos se aplicam à sua operação.