uma célula voltaica, muitas vezes conhecida como uma célula galvânica, fornece energia elétrica. A fonte dessa energia é uma reação química espontânea, mais especificamente uma reação redox espontânea.por exemplo, todas as baterias são feitas de uma ou mais células voltaicas;as baterias ficam planas quando a maioria ou todos os seus reagentes foram convertidos em produtos, transformando sua energia potencial química em energia elétrica.
células voltaicas-o processo básico
Chemical Potential Energy → Electrical Energy
The voltaic cell is one of two basic types of electrochemical cell.O outro tipo é a célula eletrolítica; em uma célula eletrolítica, a energia elétrica é usada para conduzir uma reação química não espontânea.Por exemplo, a água pode ser dividida em hidrogênio e oxigênio em uma célula eletrolítica. Além disso, quando uma bateria recarregável é recarregada, ela opera como uma célula eletrolítica.
Basic Célula Voltaica Esquemática

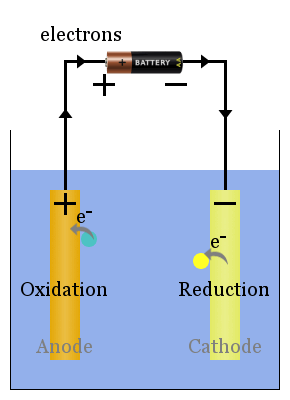
Espontânea de reações redox em eletrodos de produzir uma tensão.Correctamente configurada, esta tensão pode conduzir electrões através de dispositivos eléctricos, como a lâmpada mostrada here.In este diagrama, espécies transferem elétrons para o ânodo de onde eles fluem através da lâmpada para o cátodo, onde eles trazem redução.
Basic Eletrolítico Esquemática da Célula
Não-espontânea de reações redox são conduzidos por uma tensão externa.Os processos da célula eletrolítica são o oposto da célula voltaica.a corrente da fonte de energia empurra os elétrons para o cátodo, onde eles causam a redução de espécies para acontecer.
leia mais aqui sobre cátodos e ânodos em células voltaicas vs electrolíticas.a bateria de Edison é uma célula simples e recarregável inventada por Thomas. Edison.It consiste em dois eletrodos metálicos, um feito de ferro, o outro de níquel.Durante a carga inicial, forma-se um revestimento de óxido de níquel no eléctrodo de níquel.
o electrólito (o líquido iónico entre os eléctrodos) é de 20-30%, em peso, de hidróxido de potássio na água.O papel do hidróxido de potássio neste caso é aumentar a condutividade iônica para completar o circuito elétrico – hidróxido de potássio não é consumido na reação.
Quando está descarregando, a célula de Edison opera como uma célula voltaica.Quando está sendo carregado, a célula opera como uma célula eletrolítica.as equações químicas para as reacções nos eléctrodos são::
Durante a descarga, quando a célula está o fornecimento de energia elétrica, as reações acima, vá para a direita →.durante a carga, quando a célula está convertendo energia elétrica para energia potencial química, as reações acima seguem para a esquerda.
a célula de Edison, com ambos os eléctrodos partilhando o mesmo electrólito, é uma das células voltaicas mais simples em uso prático.; a maioria das células voltaicas são mais complicadas.As suas grandes vantagens são a sua notável robustez contra erros como a sobrecarga e a sua longa vida profissional, com ciclos de descarga de cargas quase ilimitadas.
a sua maior desvantagem é que, em relação à sua produção de energia, é muito pesada.
outro exemplo
Baterias De Lítio
avanços na tecnologia de baterias têm conduzido a miniaturização de dispositivos eletrônicos.Sem estes avanços, dispositivos modernos como celulares e tablets seriam maiores e mais pesados.
no centro destes avanços tem sido a tecnologia de iões de lítio.O elemento lítio é um metal de muito baixa densidade: a 0,534 g/cm3 lítio é metade da densidade da água; lítio flutua sobre a água.Compare isso com os metais na célula de Edison, a densidade do níquel é 8.908 g/cm3, e a do ferro é 7.874 g/cm3: estes são mais de 10x mais elevados do que a densidade do lítio.o alto potencial redox do lítio combinado com sua baixa densidade torna seus íons perfeitos para uso como material de bateria.
uma bateria típica de iões de lítio é baseada em eletrodos porosos que permitem que íons de Li se movam para dentro e para fora de seus poros.Por exemplo, uma bateria de iões de lítio recarregável poderia ter um eletrodo de grafite e um eletrodo de óxido de cobalto dopado com lítio com um eletrólito de polioxietileno contendo o sal LiPF6.quando tal bateria está alimentando um dispositivo, átomos de lítio mantidos dentro da estrutura da camada do ânodo de grafite são oxidados para se tornarem íons.
no cátodo, os íons de lítio são reduzidos dentro da estrutura do óxido de cobalto.
These reactions are reversed when the cell is being charged.
