Nome Genérico: heparina de sódio
Dosagem Forma: injeção
- Hep-Lock Descrição
- hep-Lock – Clinical Pharmacology
- indicações e utilização para Hep-Lock
- contra-indicações
- advertências
- hipersensibilidade
- hemorragia
- foi relatada a ocorrência de trombocitopenia
- Interações Medicamentosas
- Utilização geriátrica foi notificada uma maior incidência de hemorragia em doentes com mais de 60 anos de idade, especialmente mulheres (ver farmacologia clínica e precauções gerais). reacções adversas hemorragia
- trombocitopenia, trombocitopenia induzida pela heparina (HIT) e trombocitopenia e trombose induzida pela heparina (hit) e início tardio do HIT e HIT
- sobredosagem
- sintomas
- tratamento – neutralização do efeito heparina
- manutenção da patente de dispositivos intravenosos
- retirada de amostras de sangue
- Como é Hep-Bloqueio Fornecido
- de Armazenamento
Hep-Lock Descrição
a Heparina é um grupo heterogêneo de reta cadeia aniônico mucopolissacarídeos, chamado de glicosaminoglicanos, tendo propriedades anticoagulantes. Embora outros possam estar presentes, os principais açúcares ocorrendo em heparina são: (1) α-L-iduronic ácido 2-sulfato, (2) 2-desoxi-2-sulfamino-α-D-glicose 6-sulfato, (3) β-D-glucurónico, (4) 2-acetamido-2-desoxi-α-D-glicose e (5) α-L-iduronic ácido. Estes açúcares estão presentes na diminuição das quantidades, normalmente na ordem (2)>>>>(5), e são unidas entre si por ligações glicosídicas, formando polímeros de diferentes tamanhos. A heparina é fortemente ácida devido ao seu conteúdo de grupos ligados covalentemente sulfato e ácido carboxílico. Na heparina sódica, os prótons ácidos das unidades de sulfato são parcialmente substituídos por íons de sódio.fórmula estrutural da heparina sódica (subunidades representativas):
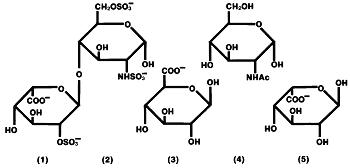
Hep-Lock U / P (conservante-Free heparina Lock Flush Solution, USP) é uma solução estéril para lavagem intravenosa apenas. Não deve ser utilizado em terapêutica anticoagulante. Hep-Lock U / P é especialmente formulado para uso em situações em que o uso de conservantes não é aconselhável. Cada mL contém heparina de sódio a 10 ou 100 unidades da USP, derivada a partir de intestinos de suínos e padronizado para uso como um anticoagulante, cloreto de sódio, 8 mg, fosfato monobásico de sódio monohidrato de 2,3 mg e de fosfato de sódio dibásico anidro 0,5 mg Água para Injeção. pH 5.0-7.5. A potência é determinada por ensaio biológico utilizando um padrão de referência USP baseado em unidades de actividade de heparina por miligrama.
hep-Lock – Clinical Pharmacology
heparina inibe reacções que conduzem à coagulação do sangue e à formação de coágulos de fibrina, tanto in vitro como in vivo. A heparina actua em vários locais do sistema normal de coagulação. Pequenas quantidades de heparina em associação com a antitrombina III (cofator da heparina) podem inibir a trombose através da inactivação do Factor X activado e da inibição da conversão da protrombina em trombina. Uma vez desenvolvida a trombose activa, quantidades maiores de heparina podem inibir a coagulação através da inactivação da trombina e da prevenção da conversão do fibrinogénio em fibrina. A heparina também previne a formação de um coágulo de fibrina estável inibindo a activação do factor estabilizador da fibrina.o tempo de hemorragia não é afectado pela heparina. O tempo de coagulação é prolongado por doses terapêuticas completas de heparina; na maioria dos casos, não é mensuravelmente afectado por doses baixas de heparina. As parcelas loglineares das concentrações plasmáticas de heparina com o tempo, para uma vasta gama de níveis de dose, são lineares, o que sugere a ausência de processos de ordem zero. O fígado e o sistema retículo-endotelial são os locais de biotransformação. A curva bifásica de eliminação, uma fase alfa em rápido declínio (t½ = 10 min), e depois dos 40 anos uma fase beta mais lenta, indica a absorção nos órgãos. A ausência de uma relação entre a semi-vida do anticoagulante e a semi-vida da concentração pode reflectir factores como a ligação da heparina às proteínas.os doentes com mais de 60 anos de idade, após doses semelhantes de heparina, podem ter níveis plasmáticos mais elevados de heparina e tempos de tromboplastina parcial activada mais longos (APTTs) comparativamente com os doentes com menos de 60 anos de idade.a heparina não tem actividade fibrinolítica, pelo que não irá lirar os coágulos existentes.
indicações e utilização para Hep-Lock
Hep-Lock U/P (conservante-Free heparina Lock Flush Solution, USP) destina-se a manter a patência de um dispositivo de venopunctura interior concebido para injecção intermitente, terapia de perfusão ou amostragem de sangue. A solução de bloqueio da heparina pode ser utilizada após a colocação inicial do dispositivo na veia, após cada injecção de um medicamento ou após a retirada do sangue para testes laboratoriais. (Ver dosagem e administração, manutenção da patente de dispositivos intravenosos para instruções de Utilização.)
Hep-Lock U / P não deve ser utilizado na terapêutica anticoagulante.
contra-indicações
heparina sódica não deve ser utilizada em doentes com as seguintes condições: trombocitopenia grave; um estado de hemorragia activo incontrolável (ver advertências), excepto quando se deve a coagulação intravascular disseminada.
advertências
heparina não se destina à utilização intramuscular.
hipersensibilidade
os doentes com hipersensibilidade documentada à heparina só devem ser tratados com o fármaco em situações claramente com risco de vida. (Ver reacções adversas, hipersensibilidade.)
hemorragia
hemorragia pode ocorrer em praticamente qualquer local em doentes a receber heparina. Uma queda inexplicável no hematócrito, queda na pressão arterial ou qualquer outro sintoma inexplicável deve levar a uma consideração séria de um evento hemorrágico.heparina sódica deve ser usada com extrema precaução em estados de doença em que há maior risco de hemorragia. Algumas das condições em que existe risco aumentado de hemorragia são: endocardite bacteriana subaguda
Cardiovascular
, hipertensão grave.durante e imediatamente após a (a) anestesia da coluna vertebral ou da coluna vertebral ou (B) grande cirurgia, especialmente envolvendo o cérebro, a medula espinhal ou o olho.Condições hematológicas
associadas a um aumento das tendências hemorrágicas, tais como hemofilia, trombocitopenia e algumas púrpuras vasculares.lesões ulcerosas gastrointestinais e drenagem contínua do estômago ou intestino delgado.menstruação, doença hepática com hemostase diminuída.
foi relatada a ocorrência de trombocitopenia
trombocitopenia em doentes a receber heparina com uma incidência notificada de até 30%. A contagem de plaquetas deve ser obtida no início e periodicamente durante a administração de heparina. A trombocitopenia ligeira (Contagem superior a 100.000/mm3) pode permanecer estável ou reversa mesmo que a heparina seja continuada. No entanto, a trombocitopenia de qualquer grau deve ser cuidadosamente monitorizada. Se a contagem for inferior a 100.000/mm3 ou se se desenvolver trombose recorrente (ver trombocitopenia induzida pela heparina e trombocitopenia e trombose induzidas pela heparina), o medicamento deve ser interrompido e, se necessário, administrado um anticoagulante alternativo.a trombocitopenia induzida pela heparina (TIH) e a trombocitopenia induzida pela heparina e a trombose (TIH)
a trombocitopenia induzida pela heparina (TIH) é uma reacção grave mediada por anticorpos resultante da agregação irreversível das plaquetas. A HIT pode progredir para o desenvolvimento de tromboses venosas e arteriais, uma condição referida como trombocitopenia induzida pela heparina e trombose (HIT). Os acontecimentos trombóticos podem também ser a apresentação inicial do HITT. Estes acontecimentos tromboembólicos graves incluem trombose venosa profunda, embolia pulmonar, trombose venosa cerebral, isquemia dos membros, acidente vascular cerebral, enfarte do miocárdio, trombose mesentérica, trombose arterial renal, necrose da pele, gangrena das extremidades que pode levar à amputação e possivelmente à morte. A trombocitopenia de qualquer grau deve ser cuidadosamente monitorizada. Se a contagem de plaquetas descer abaixo de 100.000/mm3 ou se se desenvolver trombose recorrente, o medicamento heparina deve ser imediatamente interrompido e devem considerar-se anticoagulantes alternativos caso os doentes necessitem de anticoagulação continuada.pode ocorrer trombocitopenia induzida pela heparina e trombocitopenia e trombose induzida pela heparina até várias semanas após a descontinuação da terapêutica com heparina. Os doentes que apresentem trombocitopenia ou trombose após a descontinuação da heparina devem ser avaliados para detecção de TIH e tit.a concentração de 100 unidades / mL não deve ser utilizada em recém-nascidos ou em lactentes com peso inferior a 10 kg devido ao risco de anticoagulação sistémica. É necessária precaução quando se utiliza a concentração de 10 unidades / mL em lactentes prematuros com peso inferior a 1 kg que estejam a receber afrontamentos Frequentes, Uma vez que pode ser administrada uma dose terapêutica de heparina ao lactente num período de 24 horas.precauções devem ser tomadas quando medicamentos incompatíveis com a heparina são administrados através de um cateter intravenoso contendo conservantes, sem heparina. (SeeDOSAGE and ADMINISTRATION, Maintenance of Patency of Intravenous Devices.) A concentração de fósforo na solução de heparina é de 0, 63 mg/mL.
trombocitopenia, trombocitopenia induzida pela heparina (TIH) e trombocitopenia induzida pela heparina e trombose (TIH)
durante todo o curso da terapêutica com heparina, independentemente da via de administração, recomenda-se a realização de análises laboratoriais, contagens periódicas de plaquetas, hematócritos e testes para detecção de sangue oculto nas fezes. (SeeDOSAGE and ADMINISTRATION.)
Interações Medicamentosas
Inibidores de Plaquetas
Drogas como o ácido acetilsalicílico, dextran, phenylbutazone, ibuprofeno, indometacina, dipiridamol, hidroxicloroquina e outros que interferem com plaquetas de agregação de reações (o principal hemostático defesa de heparinizado pacientes) podem induzir sangramento e deve ser usado com cautela em pacientes que recebem heparina de sódio.outras interacções digitálicos, tetraciclinas, nicotina ou anti-histamínicos podem contrariar parcialmente a acção anticoagulante da heparina sódica.não foram realizados estudos a longo prazo em animais para avaliar o potencial carcinogénico da heparina sódica. Além disso, não foram realizados estudos de reprodução em animais relativos à mutagénese ou à diminuição da fertilidade.não foram realizados estudos de reprodução em animais com heparina sódica. Também não se sabe se a heparina sódica pode causar danos fetais quando administrada a uma mulher grávida ou pode afectar a capacidade de reprodução. Heparina sódica só deve ser administrada a uma mulher grávida se for claramente necessário.efeitos Nãoteratogénicos a heparina não atravessa a barreira placentária.a heparina não é excretada no leite humano.a segurança e eficácia em doentes pediátricos não foram estabelecidas (ver advertências, utilização em recém-nascidos e lactentes).
Utilização geriátrica foi notificada uma maior incidência de hemorragia em doentes com mais de 60 anos de idade, especialmente mulheres (ver farmacologia clínica e precauções gerais).
reacções adversas
hemorragia
hemorragia é a principal complicação que pode resultar do uso de heparina (semeaduras, hemorragia). Um tempo de coagulação excessivamente prolongado ou uma pequena hemorragia durante o tratamento pode normalmente ser controlada retirando o medicamento (ver sobredosagem).
trombocitopenia, trombocitopenia induzida pela heparina (HIT) e trombocitopenia e trombose induzida pela heparina (hit) e início tardio do HIT e HIT
SeeWARNINGS.foram notificadas irritação e eritema locais com a utilização de solução de bloqueio de heparina.foram notificadas reacções de hipersensibilidade generalizada, com arrepios, febre e urticária como as manifestações mais habituais, e asma, rinite, lacrimejo, cefaleias, náuseas e vómitos, e reacções anafilactóides, incluindo choque, ocorrendo mais raramente. Pode ocorrer comichão e queimadura, especialmente no lado plantar dos pés.foi notificada trombocitopenia em doentes a receber heparina com uma incidência notificada de até 30%. Embora muitas vezes leve e sem significado clínico óbvio, tal trombocitopenia pode ser acompanhada por complicações tromboembólicas graves, tais como necrose da pele, gangrena das extremidades que podem levar à amputação, enfarte do miocárdio, embolia pulmonar, acidente vascular cerebral e possivelmente morte. (Ver advertências e precauções.)
certos episódios de membros dolorosos, isquémicos e cianetos foram no passado atribuídos a reacções vasospásticas alérgicas. Ainda não foi determinado se estes são de facto idênticos às complicações associadas à trombocitopenia.
sobredosagem
sintomas
a hemorragia é o principal sinal de sobredosagem com heparina. Podem notar-se hemorragias nasais, sangue na urina ou fezes tardias como o primeiro sinal de hemorragia. Nódoas negras fáceis ou formações petequiais podem preceder a hemorragia.
tratamento – neutralização do efeito heparina
quando circunstâncias clínicas (hemorragia) requerem reversão da heparinização, o sulfato de protamina (solução a 1%) por perfusão lenta neutraliza a heparina sódica. Não devem ser administrados mais de 50 mg, muito lentamente, em qualquer período de 10 minutos. Cada mg de sulfato de protamina neutraliza aproximadamente 100 unidades de heparina USP. A quantidade de protamina necessária diminui com o tempo à medida que a heparina é metabolizada. Embora o metabolismo da heparina seja complexo, pode, com o objectivo de escolher uma dose de protamina, assumir-se que tem uma semi-vida de cerca de 1/2 hora após a injecção intravenosa.a administração de sulfato de protamina pode causar reacções hipotensivas graves e anafilactóides. Uma vez que foram notificadas reacções fatais muitas vezes semelhantes a anafilaxia, o medicamento deve ser administrado apenas quando estão prontamente disponíveis técnicas de reanimação e tratamento de choque anafilactóide.para mais informações consulte a rotulagem da injecção de sulfato de protamina, produtos USP.os medicamentos para uso parentérico devem ser inspeccionados visualmente para detecção de partículas e descoloração antes da administração, sempre que a solução e o recipiente o permitam. Ligeira descoloração não altera a potência.não se recomenda a utilização em recém-nascidos e lactentes de solução de bloqueio heparina isenta de conservantes na concentração de 100 unidades/mL (ver advertências, utilização em recém-nascidos e lactentes).
manutenção da patente de dispositivos intravenosos
para prevenir a formação de coágulos num dispositivo de bloqueio heparina ou cateter venoso central após a sua inserção adequada, solução de descarga de bloqueio heparina, USP é injectado através do cubo de injecção numa quantidade suficiente para encher todo o dispositivo. Esta solução deve ser substituída sempre que o dispositivo for utilizado. Aspire antes de administrar qualquer solução através do dispositivo, a fim de confirmar a patência e a localização da ponta da agulha ou do cateter. Se o medicamento a administrar for incompatível com a heparina, todo o dispositivo deve ser lavado com solução salina normal antes e depois da administração do medicamento; após o segundo autoclismo salino, a solução de bloqueio de heparina, a USP pode ser reintroduzida no dispositivo. As instruções do fabricante do dispositivo devem ser consultadas para informação específica sobre a sua utilização. Normalmente, esta solução diluída de heparina manterá a anticoagulação dentro do dispositivo até 4 horas.nota: uma vez que injecções repetidas de pequenas doses de heparina podem alterar os testes do tempo parcial de tromboplastina activada (APTT), deve obter-se um valor de base para o APTT antes da inserção de um dispositivo intravenoso.
retirada de amostras de sangue
solução de bloqueio heparina isenta de conservantes, o USP pode também ser utilizado após cada retirada de sangue para testes laboratoriais. Quando a heparina interferir ou alterar os resultados das análises ao sangue, a solução de heparina deve ser retirada do dispositivo, aspirando-a e descartando-a antes de retirar a amostra de sangue.
Como é Hep-Bloqueio Fornecido
Hep-Bloqueio U/P (Conservante Livre de Heparina de Bloqueio Flush Solução, USP)
10 unidades da USP/mL
1 mL DOSETTE frascos embalados em 25s (NDC 0641-0272-25)
100 unidades da USP/mL
1 mL DOSETTE frascos embalados em 25s (NDC 0641-0273-25)
de Armazenamento
Armazenamento a 20°-25°C (68°-77°F) .Tahata T, Shigehito M, Kusuhara K, Ueda Y, et al. Início tardio da trombocitopenia induzida pela heparina – um relatório de caso – JPN Assn Torca Surg.1992;40(3):110-111.Warkentin T, Kelton J. Trombocitopenia induzida pela heparina retardada e trombose. Anais da Medicina Interna. 2001;135:502-506.Rice L, Attisha W, Drexler a, Francis J. Annals of Internal Medicine, 2002; 136: 210-215.Dieck J., C. Rizo-patrono, et al. (1990). “A New Manifestation and Treatment Alternative for heparina-Induced trombose.” Peito.1990;98:1524-26.Smythe M, Stephens J, Mattson. Trombocitopenia Induzida Pela Heparina Retardada. Anais de Medicina de emergência, 2005;45(4):417-419.
esi logo, Hep-Lock e Dosette são marcas registadas da Baxter International, Inc., ou suas subsidiárias.
fabricado por Baxter Healthcare Corporation
Deerfield, IL 60015 EUA
para o Inquérito ao produto 1 800 droga ANA (1-800-262-3784)
MLT-00090/6.0
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Baxter Healthcare Corporation
Medical Disclaimer