A hibridação teoria é muitas vezes visto como um longo e confuso conceito e é uma habilidade útil para ser capaz de determinar rapidamente se o átomo é sp3, sp2 ou sp sem ter que passar por todos os detalhes de como a hibridação tinha acontecido.
felizmente, há um atalho ao fazer isso e neste post, vou tentar resumir isso em alguns passos distintos que você precisa seguir.digamos que lhe é pedido que determine o estado de hibridação dos átomos numerados na seguinte molécula:

a primeira coisa que precisa de fazer é determinar o número de grupos que estão em cada átomo. Por grupos, queremos dizer átomos ou pares solitários de elétrons. Este também é conhecido como o número estérico (SN).

abaixo estão alguns exemplos de números estéricos 2-4 que é em grande parte o que você precisa saber em Química Orgânica:

Notice that multiple bonds do not matter, it is atoms + lone pairs for any bond type.
uma Vez que você sabe como determinar o estéricos número (é a partir da teoria VSEPR), basta aplicar a seguinte correlação:
Se o estéricos é a de número 4, é sp3
Se o estéricos número é 3 – sp2
Se o estéricos número é 2 – sp
Então, agora, vamos voltar para o nosso molécula e determinar a hibridação estados para todos os átomos.
C1 – SN = 3 (três átomos ligados), portanto, é sp2
C2 – SN = 3 (três átomos ligados), portanto, é sp2
O4 – SN = 3 (1 atom + 2 solitário pares), portanto, é sp2
O5 – SN = 4 (2 átomos de + 2 solitário pares), portanto, é sp3
C6 – SN = 4 (4 átomos), portanto, é sp3
C7 – SN = 4 (4 átomos), portanto, é sp3
N8 – SN = 4 (3 átomos de + 1 par solitário), portanto, é sp3
C9 – SN = 2 (2 átomos), portanto, ele é de sp
C10 – SN = 2 (2 átomos), portanto, ele é de sp

além este método, também é muito útil lembrar alguns traços relacionados com a estrutura e hibridação. Em geral, um átomo com todas as ligações únicas é um sp3 hibridizado. O melhor exemplo é os alcanos. Todos os átomos de carbono em um alquano são hibridizados com geometria tetraédrica.
os Carbões em alcenos e outros átomos com uma ligação dupla são muitas vezes hibridizados sp2 e têm geometria trigonal planar.a ligação tripla, por outro lado, é característica para alkynes onde os átomos de carbono são hibridizados por sp.
existem algumas exceções comuns ao que temos discutido sobre a determinação do Estado de hibridação e elas estão principalmente relacionadas com o método onde olhamos para o tipo de ligação do átomo.por exemplo, no dióxido de carbono (CO2), o carbono tem duas ligações duplas, mas é hibridizado por sp.
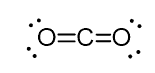
E o motivo para isso é o fato de que o estéricos número do carbono é de dois (há apenas dois átomos de oxigênio ligados a ele) e, para manter dois átomos em 180o, que é a melhor geometria, o carbono precisa usar dois idênticos orbitais. Isso só é possível na hibridação sp. Os outros dois orbitais 2p são usados para fazer as ligações duplas em cada lado do carbono.
outro exemplo comum, e muito importante são as carbocações.

Aqui o carbono tem apenas um único títulos e pode parecer que é suposto ser hibridizado sp3. No entanto, o carbono neste tipo de carbocações é hibridizado sp2. Mais uma vez, pela mesma razão, que seu número estérico é 3 (sp2 – três orbitais idênticos).
uma excepção ao método do número estérico
uma excepção com o número estérico é, por exemplo, as amidas. O átomo de nitrogénio aqui tem o número estérico 4 e espera-se que seja sp3. No entanto, devido à deslocalização de ressonância do Par solitário, ele interconverte de sp3 para sp2, pois é a única maneira de ter os elétrons em uma orbital p alinhada que pode se sobrepor e participar na estabilização de ressonância com os elétrons de ligação pi da ligação C=O dupla.

na maioria dos casos, não terá de se preocupar com as excepções se se basear no número estérico.