Um bom ponto de partida para quando você deve encontrar a configuração eletrônica de um íon é a configuração eletrônica do átomo neutro.
In your case, you must find the electron configuration of the fluoride anion, # ” F ” ^ ( -)#, so start by writing the electron configuration of a neutral fluorine atom,#”F”#.
flúor está localizado no período 2, grupo 17 da tabela periódica e tem um número atômico de #9#. Isto diz-lhe que o átomo neutro de flúor tem um total de electrões #9# em torno do seu núcleo.
Sua configuração eletrônica será
#”F:” 1s^2 2s^2 2p^5#
Agora, o #”F”^(-)# ânion é formada quando o #1# elétron é adicionado a um neutro átomo de fluor.
Notice that the 2p-subshell of the neutral atom contains # 5 # electrons. Sua capacidade máxima é na verdade 6 # elétrons, dois elétrons para cada p-orbital.
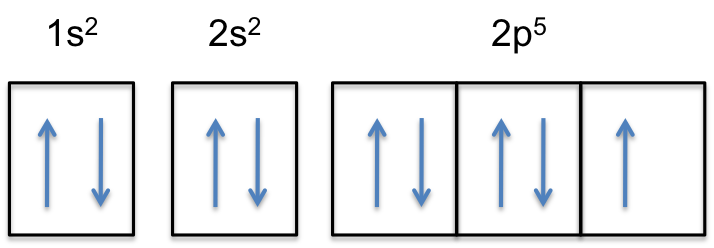
isto significa que a #cor(vermelha)(“elétron extra”)# será adicionada a um dos três orbitais 2p, digamos #2p_y#.
a subtilha 2p será agora completamente preenchida, ou seja, irá conter elétrons #6#.
a configuração electrónica do anião fluoreto será, portanto,
#cor(verde) (/bar(cor(branca) (a / a)cor(Preto) (“F”^( -):cor(branco)(a) 1s^2color(branco)(a) 2s^2 cores(branco)(a)2p^6)cor(branco)(um/a)|)))#
Observe que o ânion fluoreto tem um total de #8# elétrons na sua segunda casca, o mais externo shell. Isto diz – lhe que o anião tem um octeto completo.
Porque o ânion fluoreto é isoelectronic com neon, #”Ne”#, você pode escrever a sua configuração eletrônica usando o gás nobre notação abreviada como
#”F”^(-): #
Aqui
## – a configuração eletrônica de néon