Well, consider delocalization of electron density. Isto é quando a densidade de elétrons é espalhada tanto quanto possível através de uma molécula, de modo que o acúmulo de carga mínima está presente em um determinado orbital.
Que é descrito:
- colectivamente por todos os contribuintes de ressonância nas estruturas de Lewis.colectivamente por todas as contribuições orbitais moleculares individuais em diagramas orbitais moleculares.
(Existem diferenças sutis entre estas, mas estas são aproximadamente análogas para a simplicidade. Veja aqui para mais detalhes.)
densidade de elétrons localização é a falta disso.
é quando colocamos toda a densidade de elétrons em alguns orbitais, ao invés de espalhá-la, e quase nunca acontece em uma molécula real ou sistema quântico (mesmo que não haja ressonância).
exemplo com estruturas de ressonância
considere a alilação isolada (não reagindo), #”C”_3″H”_5^(+)#.
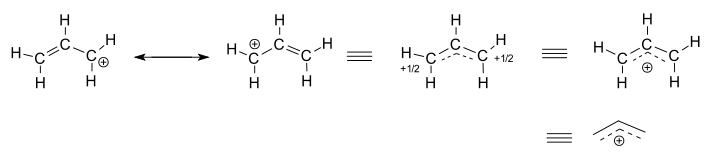
- As duas estruturas à esquerda são contribuintes de ressonância, cada uma das quais são representações localizadas da verdadeira estrutura deslocalizada.
- as três estruturas da mão direita são cada representação da estrutura híbrida de ressonância, ou a estrutura deslocalizada.
a estrutura deslocalizada é basicamente descrita por uma coleção de orbitais moleculares de ligação.
exemplo com um diagrama orbital MOLECULAR
considere a Cação Alila novamente em um diagrama MO que apenas descreve os elétrons #bbpi# (ou seja, os elétrons que estariam em uma ligação #pi# em uma ligação dupla localizada!), mas permite a participação em reações:
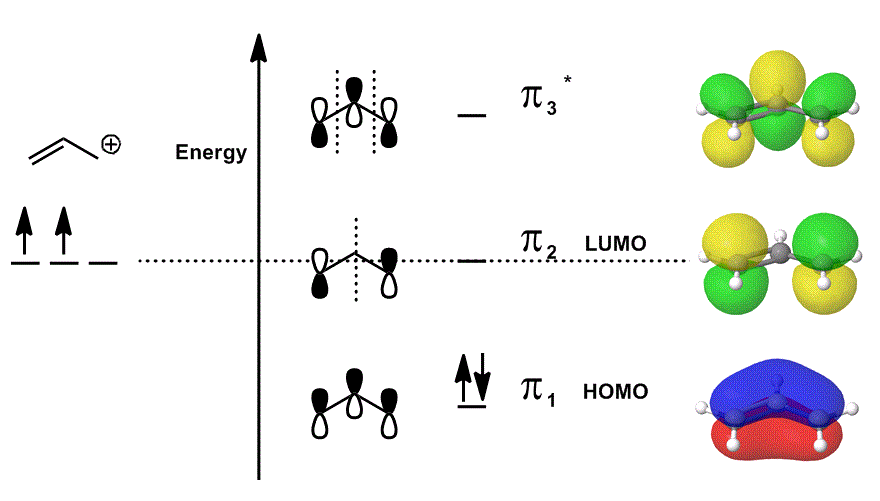
- Cada orbital de contribuições no meio são retratados localizada; os orbitais atómicas, que seriam sobrepostas são mostrados como a si mesmos (fase incluído).cada um dos orbitais à direita (um por linha) são deslocalizados; a densidade de elétrons é permitida para se espalhar de modo que os orbitais moleculares são representados com consideração completa de sobreposições, nós e fases.
Quando se sobrepõem # pi_1#, # pi_2#, e #pi_3^ ” * ” # e incorporam a contribuição ponderada destes Estados (ponderada de acordo com os coeficientes #c_i#), obtém-se a combinação linear dos orbitais moleculares:
#Psi_(“alilo”^(+)) = c_1overbrace(pi_1)^”bonding” + c_2overbrace(pi_2)^”nonbonding” + c_3overbrace(pi_3^”*”)^”antibonding”#
e #Psi_(“alilo”^ (+))#, em seguida, descreve a distribuição geral dos estados que, coletivamente, descrever a reatividade de alilo cação.
Em outras palavras, #pi_1# (que doa #pi# elétrons para bond), #pi_2# (que aceita elétrons para bond), e #pi_3^”*”# (neste caso, ele raramente vai participar) fazer algo quando o alil cação participa de uma reação química, porque (se ocupado), eles existem ao mesmo tempo.