Qual é o potencial redox de uma célula?
Reader Mode
Redox potentials are used to characterize the free energy cost and direction of reactions involving electron transfer, one of the most ubiquitous and important of biochemical reactions. Tais reações de redução-oxidação são caracterizadas por uma mudança de energia livre que compartilha algumas características conceituais com as usadas para descrever o pKa em reações ácido-base onde a transferência de prótons está envolvida ao invés de transferência de elétrons. Nesta vinheta, uma das mais abstratas do livro, discutimos como o potencial redox pode ser usado como uma medida da força motriz para uma dada reação de oxidação-redução de interesse. Em contraste, ao contrário do pH, não há sentido no qual se pode atribuir um único potencial redox a uma célula inteira.
o potencial redox, ou mais precisamente o potencial de redução, de um composto refere-se à sua tendência para adquirir electrões e, portanto, para ser reduzido. Alguns leitores podem se lembrar da mnemônica ” OILRIG “que nos lembra que” oxidação é perda, redução é ganho”, onde a perda e ganho são de elétrons. Considere uma reação que envolve uma transferência de elétrons: Aox + ne – ↔ Ared onde os elétrons n são absorvidos pela forma oxidada (Aox) para dar a forma reduzida (Ared) do composto A. O potencial redox diferença ∆ E entre o elétron doador e aceitador é relacionados com a mudança de energia livre ΔG da reação através de ΔG=nFΔE onde n é o número de elétrons transferidos e F é a constante de Faraday (96,485 J/mol/V ou ≈100 kJ/mol/V). Ao inspecionar valores tabulados desses potenciais, é possível desenvolver uma intuição para a tendência para a transferência de elétrons e, portanto, da direção da reação.

Figura 1: uma “torre redox” mostrando o potencial redox de semi-reações metabólicas comuns. Processos metabólicos podem ser vistos como elétrons em movimento entre moléculas, muitas vezes capturando parte da energia libertada à medida que os elétrons se movem de alta energia para estados de baixa energia como na glicólise ou respiração. Elétrons doados pelas” meias-reações ” no topo podem ser consumidos em uma meia-reação mais baixa na torre para completar uma reação termodinamicamente favorável. Por exemplo, o processo líquido de glicólise envolve a oxidação de glicose em piruvato acoplado à redução de NAD+ em NADH. Uma vez que a oxidação da glicose está no topo da torre e a redução de NAD+ está abaixo dela, este fluxo de elétrons é termodinamicamente favorável. Comparando com a barra da escala de hidrólise de ATP podemos também ver que este fluxo de elétrons é favorável o suficiente para gerar ATP. A respiração aeróbica envolve muitas transferências intermediárias de elétrons através da cadeia de transporte de elétrons. Várias destas transições são mostradas, incluindo a oxidação succinato a fumarato, que é mecanicamente associada à redução da ubiquinona a ubiquinol nas membranas mitocrondriais internas. Cada uma dessas transferências intermediárias de elétrons deve ser termodinamicamente favorável por si só, a fim de que a respiração prossiga. Comparando com a” escala de hidrólise de ATP ” podemos ver que as transformações individuais na cadeia de transporte de elétrons não são energéticas o suficiente para gerar ATP por conta própria. No entanto, eles são favoráveis o suficiente para bombear um próton através da célula ou membrana mitocondrial. Esta é a base energética para a quimiosmose: as células armazenam quanta de energia muito pequena para a síntese de ATP no gradiente de prótons através de uma membrana. Essa energia é mais tarde usada para gerar ATP através da conversão do gradiente h+ em ligações fosfoanidrido em ATP através da ATP sintase.
embora ATP seja muitas vezes reivindicada como a moeda de energia da célula, na verdade, para o equilíbrio energético da célula os portadores de energia redutora não são menos importantes. O exemplo mais importante destes Portadores é a molécula NADH em suas formas reduzidas ou oxidadas (NAD+). Podemos usar o potencial redox para conectar estes dois protagonistas moleculares, e estimar um limite superior sobre o número de moléculas ATP que podem ser produzidas a partir da oxidação de NADH (produzido, por exemplo, no ciclo TCA). O NAD+/NADH par tem um potencial redox de E = -0.32 V e é oxidado pelo oxigênio para dar água (prótons provenientes da comunicação social) com um potencial redox de E = +0.82 V. Ambos são mostrados na Figura 1, como parte de um “redox torre” de chave biológica meia reações que podem ser ligados para encontrar o total potencial redox alterar e, portanto, a energia livre. Para a reação considerada acima de NADH a oxidação por oxigênio, o consumo máximo de livre associado de energia que pode ser extraída é assim
ΔG = n x F x ∆ E = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
, onde n=2 e F≈100kJ/mol/V. Como a hidrólise de ATP tem uma energia livre de alteração de ≈50kJ/mol sob condições fisiológicas descobrimos que 228 kJ/mol, é suficiente para produzir um máximo de 228/50≈4.5 ATPs. Na célula, a oxidação de NADH ocorre através de vários passos na respiração e resulta na transferência de 10 prótons através da membrana contra o potencial eletroquímico (BNID 101773). Estas transferências de protões correspondem a outra forma de capturar energia bioquímica. Esta energia é então usada pela ATPase para produzir 2-3 ATPs. Assim, descobrimos que cerca de metade da energia que foi libertada na transferência de elétrons de NADH para oxigênio é conservada em ATP. Garantir que a reação prossegue de forma direcional para produzir ATP ao invés de consumi-la requer que parte da energia seja “desperdiçada”, já que o sistema deve estar fora de equilíbrio.por que se deve discutir o potencial redox de meias reações e não energias livres de reações completas? As próprias unidades devem suas origens à capacidade no campo da eletroquímica para medir no laboratório a diferença de tensão, ou seja, o potencial medido em volts, através de duas câmaras que contêm diferentes Portadores de elétrons, e para parar a reação da rede com uma tensão. A utilidade dos potenciais redox para metade das reações reside na capacidade de reunir combinações de diferentes doadores e aceitadores para avaliar a viabilidade termodinâmica e ganho de energia de cada reação considerada. Se você tem K possíveis compostos de transferência de elétrons, as reações possíveis ~k2 podem ser previstas com base apenas nos potenciais K redox.
assim como falamos do pH de uma solução, no primeiro palpite, poderíamos imaginar que seria possível falar de um potencial redox aparentemente análogo da célula. Sabendo que a concentração dos reduzido e oxidado formas de uma dada reacção par define a sua piscina potencial redox através da relação
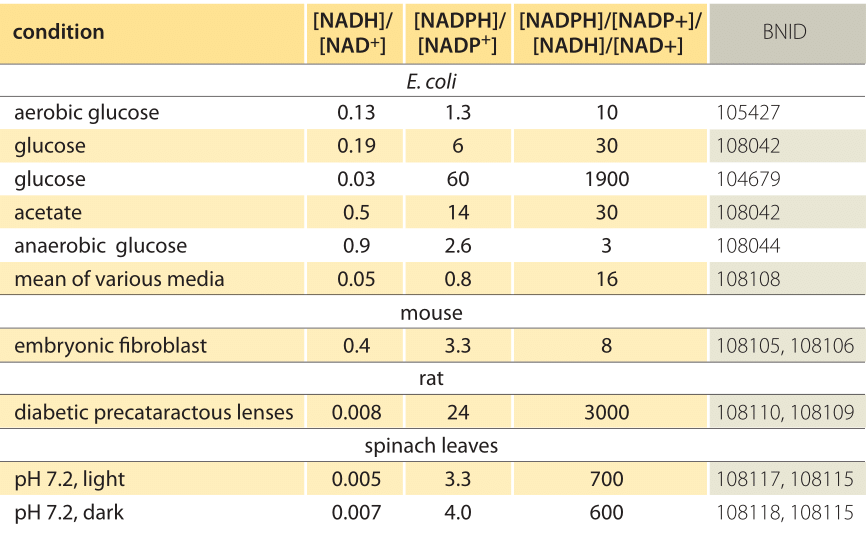
Tabela 1: rácios de concentração de comum elétron doador de pares de NAD/NADH e NADP/NADPH. Como pode ser visto, o primeiro é relativamente oxidado e o segundo relativamente reduzido com uma razão entre eles geralmente muito maior do que 1.
esta equação (uma chamada equação de Nernst) fornece o valor do potencial redox em condições de concentração típicas da célula em oposição às condições de estado padrão (onde por definição =). Como exemplo, considere a doação de um elétron para NAD+ resultando na forma oxidada NADH. Na matriz mitocondrial é relatada uma razão de 10 vezes mais da forma oxidada (BNID 100779), como mostrado na Tabela 1. Neste caso, achamos que o fator é ≈30 mV e, portanto, as alterações potenciais redox de -0,32 V para -0,29 V. Para ter certeza de que a direção do efeito que temos é sensível, notamos que com uma sobreabundância da forma oxidada a tendência a ser oxidada pelo oxigênio é um pouco menor, visto pelo fato de que o potencial redox está agora mais próximo do que antes do par de troca de elétrons oxigênio/água (+0,82 V).
uma célula não está em equilíbrio e há um acoplamento fraco entre diferentes pares redox. Esta situação leva ao estabelecimento de diferentes potenciais redox para coexistir pares redox na célula. Se os fluxos de produção e utilização dos reduzido e oxidado formas de um par redox, Ar e Aox e outro de Raça e Caixa, são muito maiores do que a sua interconversão de fluxo, Ar+Caixa de<>Aox+de Raça, em seguida, A e B podem ter muito diferentes potenciais redox. Como resultado, é mal definido para perguntar sobre o potencial redox global da célula, uma vez que será diferente para diferentes componentes dentro da célula. Em contraste, o pH da célula (ou de algum compartimento nela) é muito melhor definido, uma vez que a água serve como meio universal que une as diferentes reações ácido-base e equilibra o que é conhecido como o potencial químico de todas as espécies.
para um dado par de redox num determinado compartimento celular, a razão de concentração das duas formas prescreve o potencial redox de uma forma bem definida. Compostos que trocam elétrons rapidamente estarão em equilíbrio relativo e, portanto, compartilham um potencial redox semelhante. Para ver como estas idéias jogar fora, portanto, é mais útil considerar um par redox que participa de muitos celulares reações e, como resultado, está intimamente relacionado com o estado redox de muitos compostos. A glutationa no citoplasma é um composto que participa na redução e oxidação das ligações tiol altamente prevalentes (as que contêm enxofre) em aminoácidos cisteína de muitas proteínas. Glutationa é um tripéptido (composto por 3 aminoácidos), o central uma cisteína que pode estar em uma forma reduzida (GSH) ou oxidada onde forma um dímero com uma cisteína de outra molécula de glutationa (denotada GSSG). A meia reação para a glutationa é assim 2 x GSH <> GSSG + 2e– + 2H+. A outra metade da reação é muitas vezes uma ligação de enxofre que é “aberta” em uma proteína receptiva, sendo assim mantida na forma reduzida devido à ação constante da glutationa. Glutationa é também um jogador dominante na neutralização de compostos reativos que têm uma alta tendência para arrebatar elétrons e, portanto, oxidar outras moléculas. Tais compostos são feitos sob estresse oxidativo como por exemplo quando a capacidade das reações de transferência de elétrons da respiração ou fotossíntese é atingida. Coletivamente chamados ROS (espécies reativas de oxigênio), eles podem criar caos na célula e estão implicados em muitos processos de envelhecimento. O duplo papel da glutationa em manter as proteínas dobradas corretamente e limitando a ROS, bem como sua relativamente alta concentração e reatividade de transferência de elétrons fazem dela o principal proxy para o estado redox da célula. A concentração de glutationa na célula é ≈10mM (BNID 104679, 104704, 111464), tornando-se o segundo metabolito mais abundante na célula (depois do glutamato) garantindo que ela desempenha um papel dominante como um doador de elétrons no controle redox da função proteica. Em outras funções das células existem outros pares de elétrons dominantes. In biosynthetic anabolic reactions the NADP+ / NADPH pair and in breakdown catabolic reactions it is NAD+ / NADH.
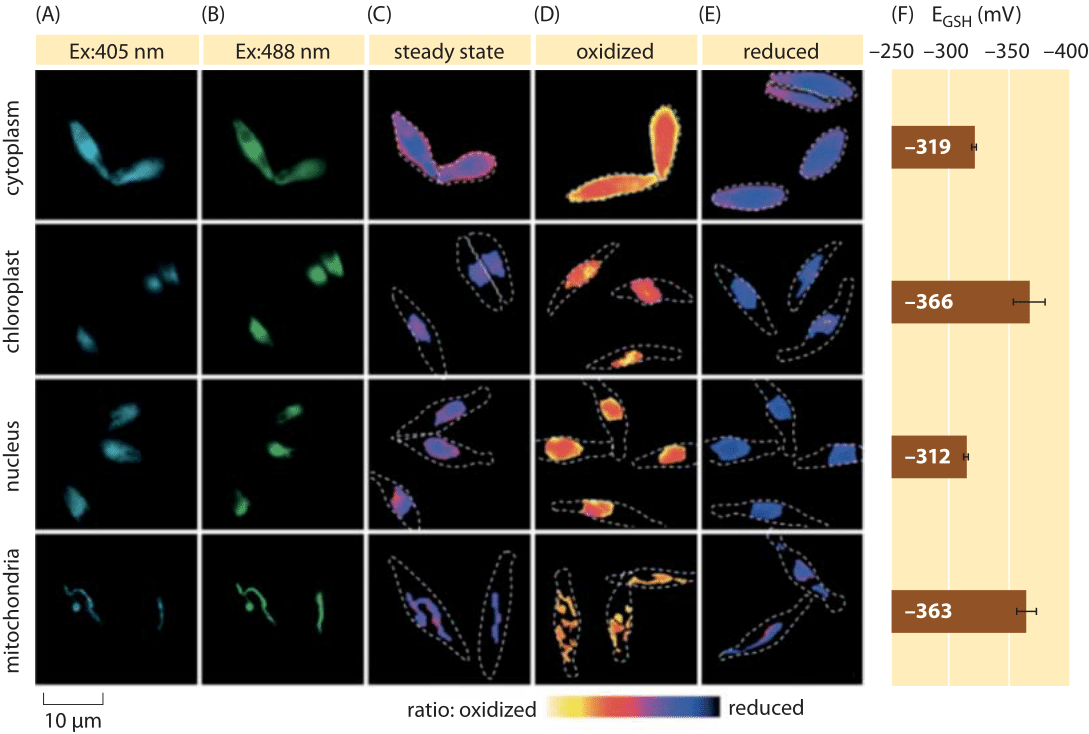
Figura 2: Imagem do potencial redox subcelular do pool de glutationa nas algas de diatomáceas in vivo. Microscopia de fluorescência de imagens de células de P. tricornutum expressando roGFP2 em várias localizações subcelulares. Imagens de fluorescência em dois comprimentos de onda de excitação (A, B), foram divididas para obter valores ratiométricos (C). Para a calibração, as imagens ratiométricas são captadas em condições oxidantes fortes (150 mM H2O2) (D) e redutoras (1 mM DTT) (E). As linhas tracejadas representam o contorno das células, desenhado com base nas imagens de campo brilhantes. F) o potencial redox em estado estacionário do pool de glutationa, EGSH em mV, foi calculado com base na equação de Nernst utilizando o nível de oxidação em valores de pH indicados para cada organela. Adaptado de: S. Graff van Creveld et al., ISME J., 9: 385, 2015.como se mede o potencial redox nas células vivas? Ainda outro beneficiário da revolução das proteínas fluorescentes foi o assunto dos potenciais redox. Um repórter GFP foi projetado para ser redox sensível pela incorporação de aminoácidos cisteína que afetam a fluorescência com base na sua redução pela piscina de glutationa. A figura 2 mostra o resultado de usar tal repórter para olhar para o potencial de glutationa redox em diferentes compartimentos de uma diatomáceas.a partir de medições do estado redox do pool de glutationa em diferentes organelas celulares e sob diferentes condições podemos inferir a razão de concentrações das formas reduzidas para oxidadas. Os valores variam de cerca de -170 mV nas urgências e nas células apoptóticas até cerca de -300 mV na maioria das outras organelas e nas células de proliferação (BNID 103543, 101823, 111456, 111465). Dado que o potencial redox padrão da glutationa é -240 mV (BNID 111453, 111463), Qual é então a razão entre a glutationa reduzida para oxidada? Usando a equação de Nernst (ou equivalentemente, a partir da distribuição de Boltzmann), uma mudança de dez vezes na razão produto/reagente corresponde a um aumento de ≈6 kJ/mol em energia livre (≈2 kBT). Dado os 2 electrões transferidos na reacção GSH / GSSG, esta alteração da razão de concentração é normalmente igual a 30mV, embora para a glutationa, a estequiometria de 2 moléculas GSH fundindo-se a uma molécula GSSG com ligação covalente torna isto apenas uma aproximação. A alteração de 100 mV notificada em todas as condições reflecte uma razão de concentrações entre cerca de quantidades iguais das formas reduzidas e oxidadas (em células apoptóticas) para mais de 1000 vezes mais concentração da forma reduzida. Na verdade, na maioria das condições celulares, a forma oxidada é apenas uma pequena fração do conjunto total, mas ainda com implicações fisiológicas.
um aspecto confuso das reações redox é que a transferência pode tomar várias formas. Em um caso são apenas elétrons como nas reações realizadas por citocromos em cadeias de transferência de elétrons. Em outro caso comum é uma combinação de elétrons e prótons como no cofactor NAD+/NADH onde dois elétrons e um próton (H+) são transferidos. Finalmente, há as reações em que o mesmo número de elétrons e prótons é transferido quando seria naturalmente tentado a discutir a transferência de hidrogénios. Este é, por exemplo, o caso da reação global de oxidação da glicose, onde o oxigênio é reduzido à água. Dois hidrogénios foram assim transferidos, por isso, deveria discutir-se a transferência de electrões, hidrogénios ou protões? A definição do potencial redox (dado acima) se concentra apenas no “estado”do elétron. E quanto aos protões e o que acontece a estes quando se encontra uma cadeia de reações de transferência de elétrons onde alguns compostos intermediários contêm os prótons de hidrogênio e alguns não? A explicação reside na água circundante e seu pH. a reação ocorre a um dado pH, e os compostos reagentes estão em equilíbrio com este pH e, portanto, dando ou recebendo um próton não tem efeito na energética. O meio aquoso serve como um pool onde prótons podem ser “estacionados” quando a reação de transferência é apenas de elétrons (a analogia emprestada a partir do livro de bioquímica introdutória muito acessível “a química da vida” de Steven Rose). Estes prótons estacionados podem ser emprestados em fases subsequentes, como ocorre na fase final da respiração oxidativa, onde a citocromo oxidase toma prótons do meio. Porque se assume que a água é onipresente não é necessário explicar por prótons, exceto por conhecer o pH prevalecente que retrata a tendência de dar ou receber prótons. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




