por Catherine Gara
janeiro 2016—o muco pode não ser algo em que gostemos de pensar, mas as nossas vidas dependem disso. Na fibrose cística (CF), o espessamento do muco leva a infecções pulmonares e bloqueios intestinais, entre outros sintomas. A doença é causada por um único gene afetado por uma ou mais das mais de 1.700 mutações conhecidas para causar a doença. Na Johns Hopkins, investigadores e geneticistas clínicos estão a trabalhar em conjunto para aprender tudo o que podem sobre o gene, a sua proteína e o que corre mal nos doentes, sabendo que cada informação que obtêm está a aproximá-los de ter opções de tratamento para todos os indivíduos com CF.nos dias de hoje, os doentes com CF estão muito melhor, graças a tratamentos que gerem as suas frequentes infecções pulmonares, mas um diagnóstico de CF ainda significa uma esperança de vida de apenas 38, devido ao seu impacto no pâncreas, fígado e intestinos. The trouble comes from defects in the cystic fibrose transmembrane conductance regulator (CFTR) gene, which carries the blueprint for the CFTR protein. A proteína CFTR é como a caixa de correio na porta da frente. Forma uma pequena passagem entre o interior e o exterior da célula.quando funciona correctamente, a TFTR ajuda a controlar a passagem de iões cloreto (um componente do sal) para dentro e para fora da célula. Nos pulmões e nas condutas do pâncreas, quando o cloreto deixa as células, incentiva a água a seguir. Essa água ajuda a formar camadas finas de muco. Nos pulmões, o muco prende poeira e bactérias que não deviam estar lá. Os cílios, ou estruturas de cabelo, nas células que alinham os pulmões, em seguida, shepherd o muco até a via aérea para a boca, onde ele é engolido e enviado para ser digerido. No pâncreas, o fluido ajuda a transportar enzimas para o intestino para ajudar na digestão alimentar. Se o muco é muito viscoso nos pulmões, os cílios não podem movê-lo para fora, então as bactérias permanecem lá para causar infecções; se é muito viscoso nos ductos pancreáticos, as enzimas não atingem o intestino, e os alimentos não digerem corretamente.Garry Cutting, professor do Instituto de Medicina Genética, e Bill Guggino, diretor do Departamento de Fisiologia, têm estudado o gene CFTR e sua proteína codificada durante a maior parte de suas carreiras. O interesse de Cutting deriva de cuidar de um par de irmãos com CF enquanto um residente na Johns Hopkins. O interesse de Guggino remonta ainda mais a suas viagens de infância ao mar. Ele se perguntou como os peixes poderiam sobreviver em água salgada, e ele aprendeu que a resposta curta é: sua versão de CFTR.se parece difícil imaginar uma carreira inteira focada em um único gene e seu produto proteico, pense nele como um cubo de Rubik complexo feito a partir de uma cadeia de 1,480 blocos magnéticos (aminoácidos). Uma mutação no gene CFTR muitas vezes significa uma mudança em um dos aminoácidos, o que pode afetar dramaticamente a forma tridimensional final.algumas mutações fazem com que a proteína não seja produzida. Outros permitem que uma proteína parcial seja sintetizada. Quanto mais perto do início da proteína essas mutações ocorrem, pior para a sua função. Outras mutações ocorrem no lugar errado e impedem o canal de sal de abrir, por exemplo. Outros ainda fazem a dobra CFTR indevidamente, o que sinaliza a equipe de controle de qualidade da célula para pegá-la e reciclá-la. E outros não interferem com a função da proteína, mas impedem-na de chegar à membrana plasmática onde faz o seu trabalho.o corte e os esforços de Guggino contribuíram para a concepção de dois medicamentos CF no mercado: ivacaftor e lumacaftor. O Ivacaftor activa a TFTR com a mutação G551D. O laboratório de Cutting relatou esta mutação pela primeira vez em 1990, e Guggino e Cutting posteriormente geraram novos insights sobre o efeito desta mutação sobre a função TFTR e os sintomas dos pacientes. Infelizmente, a mutação G551D é encontrada em apenas 4% dos pacientes com CF. No entanto, acontece que 50 por cento dos pacientes com CF têm duas cópias de uma mutação diferente (chamado delta F508), o que faz com que a TFTR seja mal formada e enviada para o caixote de reciclagem da célula. Lumacaftor impede que seja reciclado de modo a torná-lo para a membrana plasmática. Depois, o ivacaftor dá-lhe o “pontapé” que precisa de funcionar.
“O delta F508 CFTR ainda é deficiente, mas é melhor do que nada”, diz Guggino. “E isto significa que já não estamos apenas a tratar os sintomas. Estamos a tratar as causas da raiz.”
nenhuma criança deixada para trás
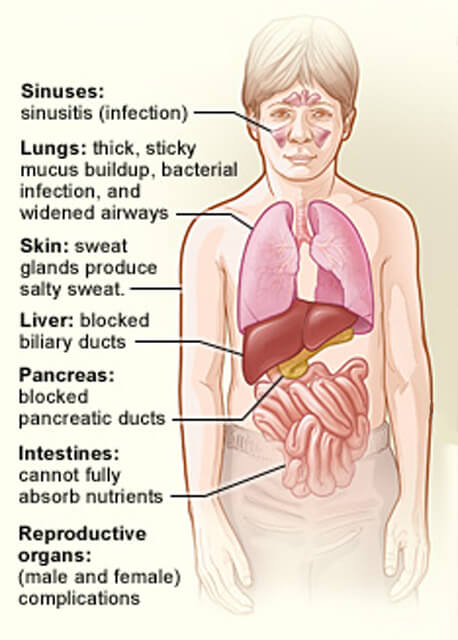 os órgãos afectados pela fibrose cística.
os órgãos afectados pela fibrose cística.Credit: National Heart, Lung and Blood Institute
the more than 40 percent of patients with other mutations — some quite rare — are not always as lucky. Existem mais de 1.700 mutações no gene CFTR que causam CF, e apenas uma pequena fração foi testada para resposta aos medicamentos aprovados. Alguns desses testados respondem a uma ou outra droga, mas outros não. Ainda assim, os pesquisadores estão esperançosos de que um dia eles serão capazes de ajudar todos. O corte prevê, eventualmente, categorizar cada paciente por teratipo, uma palavra que ele cunhou para descrever grupos de pacientes que são susceptíveis de responder à mesma terapia por causa de uma causa comum subjacente de seus sintomas. Ele tem trabalhado em estreita colaboração com os colegas Patrick Sosnay e Karen Raraigh para extrair dados de 88.000 pessoas em todo o mundo para testar o seu conceito.
Podemos usar a informação gerada por experiências em células para agrupar mutações que afetam a mesma propriedade da TFTR e, portanto, deve responder ao mesmo painel de medicamentos TFTR. Agrupar mutações de acordo com o theratype permitiria ensaios clínicos em pacientes com mutações diferentes, em vez de ensaios clínicos que avaliam uma mutação de cada vez”, diz Cutting. “É a medicina de precisão a tornar-se realidade.”
infelizmente, terapias baseadas em drogas não funcionarão para todos os pacientes com CF, especialmente os 2 por cento que não fazem nenhum TFTR. Para estes, os investigadores estão a desenvolver formas de atingir o gene mutante em si, embora ainda haja muitos obstáculos a ultrapassar.
Guggino desenvolveu um sistema de terapia genética que usa um vírus adeno-associado modificado (AAV) para depositar uma boa versão do gene CFTR dentro das células. O sistema provou-se em células e roedores das vias aéreas humanas.ao tentar uma abordagem diferente, Liudmila Cebotaru, do Departamento de Medicina, concebeu uma nova forma de combinar terapia genética e reparação de proteínas por um mecanismo chamado transcomplementação. Em vez de colocar o gene CFTR completo dentro do AAV, ela está usando uma versão mais curta que é mais facilmente inserida no genoma da célula. Quando a proteína mais curta é produzida, liga-se à proteína mutante do doente e ajuda-o a chegar à membrana plasmática. Tanto Cebotaru quanto Guggino estão testando sua nova abordagem em macacos rhesus porque seus pulmões e sistemas imunológicos estão muito próximos dos humanos. Eles esperam começar um ensaio clínico nos próximos anos, se tudo correr bem.”gosto de pensar nisso como saltar a bateria do seu carro”, diz ela. “Com um pouco de ajuda extra, as proteínas CFTR dos pacientes podem chegar ao seu destino.”
para os pesquisadores e pacientes, o destino é nada menos do que uma cura para CF. E embora ainda esteja muito longe, há sinais encorajadores de que podemos chegar lá.